
| A. | 向NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- | |
| B. | 硅酸钠溶液与醋酸溶液混合:SiO32-+2H+═H2SiO3↓ | |
| C. | MnO2与浓盐酸反应制Cl2:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O | |
| D. | 浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+$\frac{\underline{\;\;△\;\;}}{\;}$Fe3++3NO2↑+3H2O |
分析 A.反应生成氢氧化铝和碳酸氢钠;
B.醋酸在离子反应中保留化学式;
C.盐酸完全电离;
D.反应生成硝酸亚铁.
解答 解:A.向NaAlO2溶液中通入过量CO2的离子反应为AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,故A正确;
B.硅酸钠溶液与醋酸溶液混合的离子反应为SiO32-+2CH3COOH═2CH3COO-+H2SiO3↓,故B错误;
C.MnO2与浓盐酸反应制Cl2的离子反应为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,故C错误;
D.浓硝酸中加入过量铁粉并加热的离子反应为Fe+2NO3-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Fe2++2NO2↑+2H2O,故D错误;
故选A.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | c(Na+)═c(CCl3COO-)+c(CH3COO-) | |
| B. | c(CCl3COO-)-c(CH3COO-)═c(CH3COOH)-c(CCl3COOH) | |
| C. | c(OH-)>c(CCl3COO-)>c(CH3COO-) | |
| D. | c(CH3COOH)>c(CCl3COOH)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某可逆反应进行过程中,在不同反应时间各物质的量的变化情况如图所示.则该反应的化学方程式为2A+B?2C;反应开始至2分钟,能用C表示反应速率吗?不能(填“能”或“不能”),原因不能确定溶液的体积,所以不能计算浓度的变化,无法计算反应速率.
某可逆反应进行过程中,在不同反应时间各物质的量的变化情况如图所示.则该反应的化学方程式为2A+B?2C;反应开始至2分钟,能用C表示反应速率吗?不能(填“能”或“不能”),原因不能确定溶液的体积,所以不能计算浓度的变化,无法计算反应速率.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
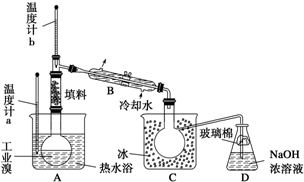 某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性.他们参观生产过程后,组装了如图装置简图:
某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性.他们参观生产过程后,组装了如图装置简图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使pH试纸变红的溶液:K+、Ca2+、Cl-、ClO- | |
| B. | 无色透明的溶液:Cu2+、NH4+、NO3-、CO32- | |
| C. | 0.1 mol•L-1KNO3溶液:Mg2+、Fe3+、Cl-、SO42- | |
| D. | 水电离出的c(H+)=10-12 mol•L-1的溶液:Na+、NH4+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖、蔗糖、油脂和蛋白质在一定条件下都能水解 | |
| B. | 等质量的甲烷、乙烯、1,3-丁二烯(C4H6)分别在空气中充分燃烧,所耗用氧气的量依次增大 | |
| C. | 不用任何试剂和仪器可鉴别乙醇、乙酸、乙酸乙酯、苯四种有机物 | |
| D. | 若甲烷与氯气以物质的量之比1:3混合,在光照下得到的产物只有CHCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com