
| A. | 一个${\;}_{88}^{226}$Ra原子中含有138个中子 | |
| B. | Ra元素位于元素周期表中第六周期ⅡA族 | |
| C. | Ra不能和冷水反应置换氢气 | |
| D. | Ra(OH)2是一种两性氢氧化物 |
分析 A、质子数+中子数=质量数;
B、Ra(镭)位于第ⅡA族,与Ca同主族,Ra元素位于元素周期表第七周期ⅡA族;
C、Ra(镭)位于第ⅡA族,与Ca同主族,镭属于金属元素,金属性比钙强;
D、镭单质比Ca金属性强,则氢氧化物为强碱.
解答 解:A、一个Ra原子中含有226-88=138个中子,故A正确;
B、Ra(镭)位于第ⅡA族,与Ca同主族,Ra元素位于元素周期表第七周期ⅡA族,故B错误;
C、Ra(镭)位于第ⅡA族,与Ca同主族,金属性比钙强,所以能和冷水反应置换氢气,故C错误;
D、镭单质比Ca金属性强,氢氧化钙是强碱,则氢氧化物为强碱,故D错误.
故选:A
点评 本题考查元素的位置及性质,明确Ra与Ca同主族是解答本题的关键,注意性质的相似性和递变性即可解答,题目难度不大.


科目:高中化学 来源: 题型:解答题
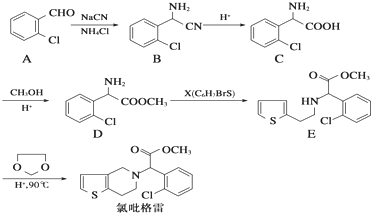 ,
, .
.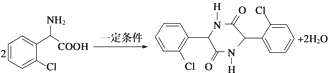 .
.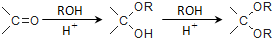 ,则由乙醇、甲醇为有机原料制备化合物
,则由乙醇、甲醇为有机原料制备化合物 ,需要经历的反应类型有①②③④(填写编号).①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应,写出制备化合物
,需要经历的反应类型有①②③④(填写编号).①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应,写出制备化合物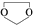 的最后一步反应
的最后一步反应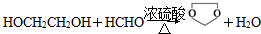 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{y}^{m}$X | B. | ${\;}_{y}^{y+m}$X | C. | ${\;}_{y+n}^{m+y+n}$X | D. | ${\;}_{y+n}^{y+m-n}$X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷和甲酸甲酯 | B. | 乙烷和乙醇 | C. | 苯和苯酚 | D. | 乙炔和苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都属于氧化还原反应 | |
| B. | 等物质的量的上述物质产生气体体积(相同状况)的大小关系是:Na2O2=CaC2<CaH2=Mg3N2 | |
| C. | Na2O2、CaH2与水反应时水作氧化剂 | |
| D. | CaH2与水反应时产生H2,它既是氧化产物和又是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 足量CO2与NaOH溶液反应:CO2+2OH-=CO32-+H2O | |
| B. | NaHCO3溶液中加入过量Ba(OH)2溶液:2HCO3-+2OH-+Ba2+=BaCO3↓+CO32-+2H2O | |
| C. | 氯化铝溶液中加入足量的氨水:Al3++3OH-=Al(OH)3↓ | |
| D. | 氯化亚铁溶液中加入硝酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
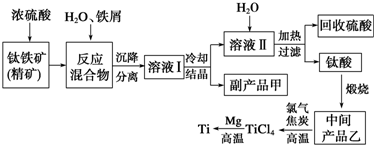
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Fe3+ | Cu2+ | Cr3+ | |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com