
【题目】已知苯甲酸微溶于水,易溶于乙醇、乙醚,有弱酸性,酸性比醋酸强。它可用于制备苯甲酸乙酯和苯甲酸铜。
(一)制备苯甲酸乙酯
COOH+C2H5OH ![]() COOC2H5+H2O
COOC2H5+H2O
相关物质的部分物理性质如表格:

实验流程如下图:

(1)制备苯甲酸乙酯,装置最合适的是下图中的________(填字母,下同)。

反应液中的环己烷在本实验中的作用____________________。
(2)步骤②控制温度在65~70 ℃缓慢加热液体回流,分水器中逐渐出现上、下两层液体,直到反应完成,停止加热。放出分水器中的下层液体后,继续加热,蒸出多余的乙醇和环己烷。反应完成的标志是___________________________________________________________。
(3)步骤③碳酸钠的作用是________________________________________________________。
(4)步骤④将中和后的液体转入分液漏斗分出有机层,水层用25 mL乙醚萃取,然后合并至有机层,用无水MgSO4干燥。乙醚的作用是____________________________________________。
(二)制备苯甲酸铜
将苯甲酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2粉未,然后水浴加热,于70~80 ℃下保温2~3小时;趁热过滤,滤液蒸发冷却,析出苯甲酸铜晶体,过滤、洗涤、干燥得到成品。
(5)混合溶剂中乙醇的作用是__________________________________________________,
趁热过滤的原因________________________________________________________。
(6)洗涤苯甲酸铜晶体时,下列洗涤剂最合适的是________。
A.冷水 B.热水
C.乙醇 D.乙醇水混合溶液
【答案】 B 通过形成水-乙醇-环己烷三元共沸物带出生成的水,促进酯化反应正向进行 分水器中下层(水层)液面不再升高 中和苯甲酸和硫酸 萃取出水层中溶解的苯甲酸乙酯,提高产率 增大苯甲酸的溶解度,便于充分反应 苯甲酸铜冷却后会结晶析出,如不趁热过滤会损失产品 C
【解析】(1)根据步骤②控制温度在65~70℃缓慢加热液体回流,可判断选择水浴加热的方式,要控制水浴的温度,所以温度计应测量水的温度;由于水-乙醇-环己烷三元共沸物,所以环己烷在本实验中的作用是可以带出生成的水,可使酯化反应正向进行;
(2)根据反应产物可知,当反应完成时,不再产生水,分水器中下层(水层)液面不再升高,所以反应完成的标志是分水器中下层(水层)液面不再升高;
(3)反应物中用了苯甲酸和硫酸,所以加入碳酸钠可以中和酸,酸与碳酸钠反应可以产生泡沫,所以加入的速度不能快;
(4)苯甲酸乙酯有少量溶解中水,用乙醚可以将其萃取出来,以提高产率;
(5)苯甲酸微溶于水,使用乙醇可以增大苯甲酸的溶解度,便于充分反应;苯甲酸铜冷却后会结晶析出,所以要趁热过滤;
(6)洗涤苯甲酸铜晶体时,既要除去表面可溶性杂质,又要尽可能减小苯甲酸铜晶体的溶解,且便于干燥,苯甲酸铜易溶于水,难溶于乙醇,故选C。


科目:高中化学 来源: 题型:
【题目】N2O(笑气)、CHCl3(氯仿)都曾在医学上被用作麻醉剂。下列说法正确的是( )
A. N2O、CHCl3都易溶于水 B. N2O、CHCl3都属于电解质
C. N2O只有氧化性没有还原性 D. N2O、CHCl3都是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】57号镧元素(La)是一种活泼性比铁还强的金属元素,La的氧化物的化学式为La2O3,La(OH)3是不溶于水的碱,La的氯化物、硝酸盐均易溶于水,下列各组物质中不能直接反应得到LaCl3的是
A. La2O3+HCl B. La+Cl2
C. La(OH)3+HCl D. La(NO3)3+HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】污染物的有效去除和资源的充分利用是化学造福人类的重要课题。某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料 MnO2(反应条件已省略)。
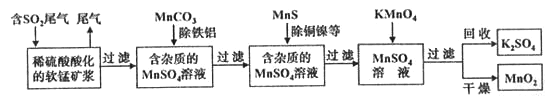
请回答下列问题:
(1)上述流程脱硫实现了____________(选填下列字母编号)。
a.废弃物的综合利用 b.白色污染的减少 c.酸雨的减少
(2)KMnO4+MnSO4→MnO2的反应中,氧化剂与还原剂的物质的量之比为____________。
(3)已知:25℃、101kPa 时,Mn(s)+O2(g)=MnO2(s) △H=-520kJ·mol-1
S(s)+O2(g)=SO2(g) △H=-297 kJ·mol-1
Mn(s)+S(s)+2O2(g)= MnSO4(s) △H=-1065 kJ·mol-1
SO2与MnO2反应生成无水MnSO4的热化学方程式为:_______________________________。
(4)MnO2可作超级电容器材料。用惰性电极电解MnSO4溶液可制得MnO2其阳极的电极反应式是__________________________________________________。
(5)MnO2是碱性锌锰电池的正极材料。碱性锌锰电池放电时,正极的电极反应式为:____________________________________________________。若以该电池为电源,以石墨作电极电解CuSO4溶液,阴极析出铜,阳极产物是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素甲、乙、丙、丁、戊在元素周期表中的位置如表所示,其中丁所处的主族序数是其周期序数的三倍。回答下列问题:
乙 | 丙 | 丁 | |
甲 | 戊 |
(1)乙在元素周期表中的位置是___________________。
(2)原子半径:戊____甲(填“>”或“<”)。
(3)乙与戊组成化合物的电子式为________________,其中化学键的类型是________(填“极性”或“非极性”)共价键。
(4)元素的非金属性:甲____丙(填“>”或“<”),下列事实能说明该结论的是_______。
A、丙的氢化物稳定,甲的氢化物不稳定
B、丙的最高价氧化物对应的水化物是强酸,甲的是弱酸
C、丙的最高价氧化物对应的水化物易溶于水,甲的难溶
(5)工业上制取甲(粗品)的化学方程式_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子材料M在光聚合物和金属涂料方面有重要用途,已知
①磷酸的结构简式为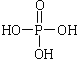
②M的结构简式为: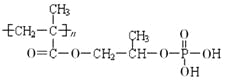
工业上合成M的过程可表示如下:
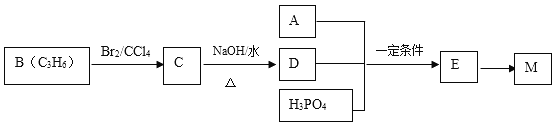
已知:A完全燃烧只生成CO2和H2O,其蒸气密度是相同状况下氢气密度的43倍,分子中H、O原子个数比为3:1。它与Na或Na2CO3都能反应产生无色气体。
(1)A中含有的官能团的名称是 。
(2)下列说法正确的是 (填字母序号)。
a.工业上,B主要通过石油分馏获得
b.C的同分异构体有2种(不包括C)
c.D易溶于水
d.E→M的反应是缩聚反应
(3)写出A+D+H3PO4→E反应的化学方程式(反应物均用结构简式表示): ,该反应类型是 反应。
(4)F是A 的一种同分异构体,F的核磁共振氢谱显示分子中有两种不同的氢原子。F存在下列转化关系:
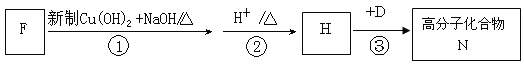
写出F、N的结构简式F: ,N: 。
写出反应①的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以冶铝的废弃物铝灰为原料制取超细α-氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:

(1)铝灰中氧化铝与硫酸反应的化学方程式为____________________________________。
(2)加30%的H2O2溶液的目的是_________________________________。
(3)煅烧硫酸铝铵晶体,发生的主要反应为:
4[NH4Al(SO4)2·12H2O] ![]() 2Al2O3 + 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。
2Al2O3 + 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。

①集气瓶中收集到的气体为___________(填化学式)。
②KMnO4溶液褪色(MnO4-还原为Mn2+),此褪色过程中,氧化剂与还原剂的物质的量之比为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com