
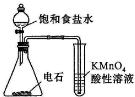
| A. | 用图装置检验乙炔的还原性 | |
| B. | 先加足量溴水,然后再加入酸性高锰酸钾溶液,鉴别己烯中是否混有少量甲苯 | |
| C. | 用裂化汽油从溴水中提取溴 | |
| D. | 将混合气体通过酸性高锰酸钾溶液,除去甲烷中混有的乙烯 |
分析 A.混有的硫化氢也能被高锰酸钾氧化;
B.先加足量溴水与烯烃反应,再加入酸性高锰酸钾溶液与甲苯反应;
C.裂化汽油中含碳碳双键;
D.乙烯被高锰酸钾氧化生成二氧化碳.
解答 解:A.混有的硫化氢也能被高锰酸钾氧化,则图中高锰酸钾不能检验乙炔的还原性,故A错误;
B.先加足量溴水与烯烃反应,再加入酸性高锰酸钾溶液与甲苯反应,则先加足量溴水,然后再加入酸性高锰酸钾溶液,可鉴别己烯中是否混有少量甲苯,故B正确;
C.裂化汽油中含碳碳双键,与溴水发生加成反应,不能萃取提取溴,故C错误;
D.乙烯被高锰酸钾氧化生成二氧化碳,引入新杂质,不能除杂,应选溴水、洗气除杂,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应及混合物分离提纯、检验等为解答的关键,侧重分析与实验能力的考查,注意有机物的性质应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 容器内${C_{({H_2})}}={C_{({I_2})}}={C_{(HI)}}$ | B. | 容器内的压强不再变化 | ||
| C. | 断裂1mol H-H的同时生成2mol H-I | D. | 容器内颜色不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L 苯中含有的苯分子数是NA | |
| B. | 标准状况下,1mol氦气中含有的核外电子数为2NA | |
| C. | 常温常压下,15g乙烷分子数目为 NA | |
| D. | 常温常压下,0.10 mol•L-1CH3COOH溶液中含有的H+数小于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溴离子具有氧化性 | B. | 溴单质是氧化剂 | ||
| C. | 该反应属于复分解反应 | D. | 氯元素的非金属性比溴元素强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
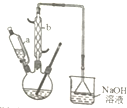 己二酸是合成尼龙-66的主要原料之一.实验室合成己二酸的原理、有关数据及装置示意图如下:
己二酸是合成尼龙-66的主要原料之一.实验室合成己二酸的原理、有关数据及装置示意图如下:
| 物质 | 密度(20℃) | 熔点 | 沸点 | 溶解性 |
| 环己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃时水中溶解度为3.6g,可混溶于乙醇、苯 |
| 己二酸 | 1.360g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时1.44g,25℃时2.3g,易溶于乙醇、不溶于苯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com