
【题目】电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。
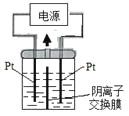
已知:3I2+6OH—=IO3—+5I—+3H2O
下列说法不正确的是
A. 右侧发生的电极方程式:2H2O+2e—=H2↑+2OH—
B. 电解结束时,右侧溶液中含有IO3—
C. 电解槽内发生反应的总化学方程式KI+3H2O=KIO3+3H2↑
D. 如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变
【答案】D
【解析】
A.左侧溶液变蓝色,生成I2,左侧电极为阳极,右侧电极为阴极,阴极上氢离子得电子生成氢气,则右侧电极反应式为:2H++2e-═H2↑,故A正确;B.一段时间后,蓝色变浅,发生反应3I2+6OH-=IO3-+5I-+3H2O,中间为阴离子交换膜,右侧I-、OH-通过阴离子交换膜向左侧移动,保证两边溶液呈电中性,左侧的IO3-通过阴离子交换膜向右侧移动,故右侧溶液中含有IO3-,故B正确;C.左侧电极为阳极,电极反应为:2I--2e-=I2,同时发生反应3I2+6OH-=IO3-+5I-+3H2O,右侧电极为阴极,电极反应式为:2H2O+2e-=H2↑+2OH-,故总的电极反应式为:KI+3H2O![]() KIO3+3H2↑,故C正确;D.如果用阳离子交换膜代替阴离子交换膜,左侧电极为阳极,电极反应为:2I--2e-=I2,右侧电极为阴极,电极反应式为:2H2O+2e-=H2↑+2OH-,保证两边溶液呈电中性,左侧多余K+通过阳离子交换膜迁移至阴极,左侧生成I2,右侧溶液中有KOH生成,碘单质与KOH不能反应,总反应相当于:2KI+2H2O
KIO3+3H2↑,故C正确;D.如果用阳离子交换膜代替阴离子交换膜,左侧电极为阳极,电极反应为:2I--2e-=I2,右侧电极为阴极,电极反应式为:2H2O+2e-=H2↑+2OH-,保证两边溶液呈电中性,左侧多余K+通过阳离子交换膜迁移至阴极,左侧生成I2,右侧溶液中有KOH生成,碘单质与KOH不能反应,总反应相当于:2KI+2H2O![]() 2KOH+I2+H2↑,电解槽内发生的总化学方程式发生变化,故D错误;故答案为D。
2KOH+I2+H2↑,电解槽内发生的总化学方程式发生变化,故D错误;故答案为D。


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
【题目】有机物X、Y、Z的结构简式如下表所示。下列说法正确的是
X | Y | Z | |
结构简式 |
|
|
|
A. X的分子式为C8H7O3
B. X、Y、Z均可以和FeCl3发生显色反应
C. X、Y互为同系物,X、Z互为同分异构体
D. X、Y、Z在一定条件下都能发生取代反应、加成反应和氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为
![]()
其中第①步存在平衡:2CrO42—(黄色)+2H+![]() Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显 色.
(2)能说明第①步反应达平衡状态的是 。
a.Cr2O72—和CrO42—的浓度相同 b.2v (Cr2O72—) ="v" (CrO42—) c.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72—离子,需要________mol的FeSO4·7H2O。
( 4 ) 第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)![]() Cr3+(aq)+3OH—(aq)
Cr3+(aq)+3OH—(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH—)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
方法2:电解法
该法用Fe做电极电解含Cr2O72—的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)用Fe做电极的原因为 。
(6)在阴极附近溶液pH升高的原因是(用电极反应解释) 。
溶液中同时生成的沉淀还有 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,体积为10L的密闭容器中,1molX和1molY进行反应:2X(g)+Y(g)![]() Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是
Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是
A. 以X浓度变化表示的反应速率为0.001mol·L-1·s-1
B. 将容器体积变为20L,Z的平衡浓度变为原来的![]()
C. 若增大压强,则物质Y的转化率减小
D. 若升高温度,X的体积分数增大,则该反应的△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物种类较多,有N2O、NO、N2O3、NO2、N2O4、N2O5等,它们应用广泛。
(1)N2O是人类最早应用于医疗的麻醉剂之一。它可由NH4NO3在加热条件下分解产生,此反应的化学方程式为______________________________。
(2)N2O4可作火箭高能燃料N2H4的氧化剂。已知:2NO2(g)![]() N2O4(g)△H=﹣akJmol﹣1;N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=﹣bkJmol﹣1;N2(g)+2O2(g)=2NO2(g)△H=+ckJmol﹣1;(a、b、c均大于0)。写出气态肼(N2H4)在气态(N2O4)中燃烧生成氮气和气态水的热化学方程式________。
N2O4(g)△H=﹣akJmol﹣1;N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=﹣bkJmol﹣1;N2(g)+2O2(g)=2NO2(g)△H=+ckJmol﹣1;(a、b、c均大于0)。写出气态肼(N2H4)在气态(N2O4)中燃烧生成氮气和气态水的热化学方程式________。
(3)平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压 × 物质的量分数[例如p(NO2)=p总×x(NO2)]。则反应2NO2(g)N2O4(g)△H=﹣akJmol﹣1平衡常数Kp表达式为______(用p总、和各气体物质的量分数x表示)。
(4)新型绿色硝化剂N2O5可以通过N2O4为原料用电解法制备,实验装置如图所示。则电极B接直流电源的___极,电解池中生成N2O5的电极反应式为______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列各题:
(1)画出Li2O的电子式________________________
(2)用电子式表示CO2分子的形成过程_________________________________________
(3)画出N2分子的结构式_________________
(4)写出全部是由H、O、S、K四种元素形成的两种盐相互反应的离子方程式__________
(5)第3周期的两种金属氧化物对应的水化物间能相互发生反应,写出其化学反应方程式_____________
(6)如图是元素周期表的一个方格  ,其中19.00的意义是___________
,其中19.00的意义是___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有4种碳骨架如图所示的烃,下列说法正确的是
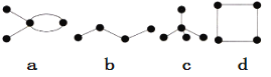
A. a和b互为同分异构体B. b和c互为同系物
C. a和b都能发生加成反应D. 只有b和c能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组烃中,所取质量一定时,无论以怎样的物质的量之比混合,燃烧生成的CO2为一定值的是( )
A. 甲烷、乙烷
B. 乙烯、丁烯
C. 丙烯、丙烷
D. 丙烷、丁烯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com