
【题目】化合物E(二乙酸-1,4-环己二醇酯)是一种制作建筑材料的原料。其合成路线如下:
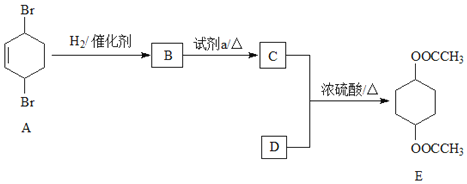
完成下列填空:
(1)A中含有的官能团是______;E的分子式是______;试剂a是______。
(2)写出反应类型:B→C______。
(3)C与D反应生成E的化学方程式:______。
(4)C的同分异构体,能使石蕊试剂显红色,写出该物质的一种结构简式______。
(5)设计一条以环己醇(![]() )为原料(其他无机试剂任取)合成A的合成路线。
)为原料(其他无机试剂任取)合成A的合成路线。
(合成路线常用的表示方式为:A![]() B……
B……![]() 目标产物)_____________________
目标产物)_____________________
【答案】碳碳双键,溴原子 C10H16O4 NaOH水溶液 取代反应 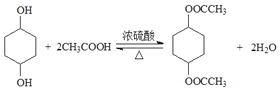 CH3(CH2)4COOH
CH3(CH2)4COOH 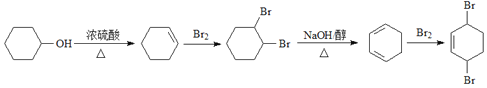
【解析】
由题给有机物转化关系可知,在催化剂作用下,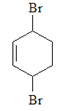 与氢气发生加成反应生成
与氢气发生加成反应生成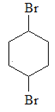 ,则B为
,则B为 ;
; 在氢氧化钠溶液中共热发生水解反应生成
在氢氧化钠溶液中共热发生水解反应生成![]() ,则C为
,则C为![]() ;在浓硫酸作用下,
;在浓硫酸作用下,![]() 与CH3COOH共热发生酯化反应生成
与CH3COOH共热发生酯化反应生成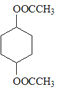 ,则D为CH3COOH。
,则D为CH3COOH。
(1)A中含有的官能团是碳碳双键、溴原子;E的分子式是C10H16O4;试剂a是NaOH水溶液,故答案为:碳碳双键、溴原子;C10H16O4;NaOH水溶液;
(2)B的结构简式为![]() ,
, 在氢氧化钠溶液中共热发生水解反应生成
在氢氧化钠溶液中共热发生水解反应生成![]() ,故答案为:水解反应或取代反应;
,故答案为:水解反应或取代反应;
(3)在浓硫酸作用下,![]() 与CH3COOH共热发生酯化反应生成
与CH3COOH共热发生酯化反应生成 ,反应的化学方程式为
,反应的化学方程式为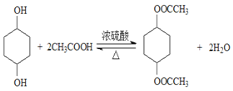 ,故答案为:
,故答案为: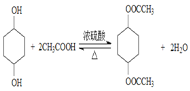 ;
;
(4)C的结构简式为![]() ,C的同分异构体能使石蕊试剂显红色,说明分子中含有羧基,可为CH3(CH2)4COOH等,故答案为:CH3(CH2)4COOH等;
,C的同分异构体能使石蕊试剂显红色,说明分子中含有羧基,可为CH3(CH2)4COOH等,故答案为:CH3(CH2)4COOH等;
(5)以环己醇(![]() )为原料合成
)为原料合成 时,可先发生消去反应生成环己烯,然后发生加成反应邻二溴环己烷,在氢氧化钠醇溶液中邻二溴环己烷发生消去反应生成1,3—环己二烯,1,3—环己二烯与溴水发生1,4加成可生成目标物,合成路线为
时,可先发生消去反应生成环己烯,然后发生加成反应邻二溴环己烷,在氢氧化钠醇溶液中邻二溴环己烷发生消去反应生成1,3—环己二烯,1,3—环己二烯与溴水发生1,4加成可生成目标物,合成路线为 ,故答案为:
,故答案为: 。
。


科目:高中化学 来源: 题型:
【题目】某课外活动小组设计了如下3个实验方案,用以检验淀粉的水解程度:
(1)甲方案:淀粉液![]() 水解液
水解液![]() 中和液
中和液![]() 溶液变蓝
溶液变蓝
结论:淀粉尚未水解。
(2)乙方案:淀粉液![]() 水解液
水解液![]() 无银镜现象
无银镜现象
结论:淀粉尚未水解。
(3)丙方案:

结论:淀粉水解完全。
上述三个方案操作是否正确?说明理由。_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂以硝酸为原料生产亚硝酸钠,其工艺流程如图:
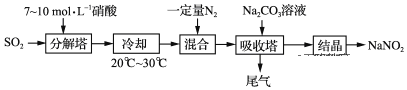
已知:Na2CO3+NO+NO2=2NaNO2+CO2
(1)“分解塔”中SO2从塔底进入,硝酸从塔顶喷淋,其目的是____。
(2)“分解塔”中的温度不宜过高,其原因是____。
(3)按一定计量比在“分解塔”中通SO2和喷入硝酸,若反应后生成的NO与NO2物质的量之比恰好1:1,则“分解塔”中发生反应的化学方程式为____。
(4)为提高氮氧化物的转化率,可向“尾气”中通入一定量的____气体,再通入“吸收塔”中,实现循环吸收。
(5)“吸收塔”所得溶液中除含有NaNO2、NaNO3和少量Na2CO3外,还含有的溶质为___(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分为:Na2Cr2O7·2H2O),其主要工艺流程如下:
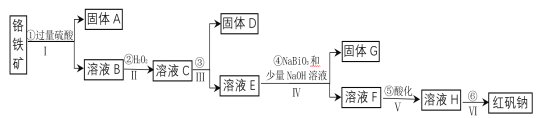
查阅相关资料得知:
i.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下能将Cr3+转化为CrO42—,自身被还原为Bi(OH)3固体。
ii.
物质 | Fe(OH)3 | Al(OH)3 | Cr(OH)3 | Fe(OH)2 | Bi(OH)3 |
开始沉淀的PH | 2.7 | 3.4 | 4.6 | 7.5 | 0.7 |
完全沉淀的PH | 3.7 | 4.4 | 5.9 | 9.7 | 4.5 |
回答下列问题:
(1)将铬铁矿矿石粉碎的目的是___________。
(2)操作I、III、IV用到的主要玻璃仪器有玻璃棒和___________(填仪器名称)。
(3)写出④反应的化学方程式________________。
(4)⑤中酸化是使CrO42—转化为Cr2O72—。写出该反应的离子方程式______。
(5)将溶液H经下列操作:蒸发浓缩,__________,过滤,洗涤,干燥即得红矾钠。
(6)取一定质量的固体D溶解于200mL的稀硫酸中,向所得溶液中加入5.0mol/L的NaOH溶液,生成沉淀的物质的量(n)与加入NaOH溶液的体积(V)关系如图所示,则稀硫酸的浓度为_________,固体D中含Fe化合物的物质的量为___________。
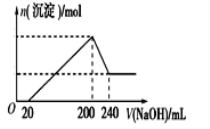
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学向SO2和Cl2的混合气体中加入品红溶液,振荡,溶液褪色,将此无色溶液分成三份,依次进行实验,实验操作和实验现象记录如下:
序号 | |||
实验操作 |
|
|
|
实验现象 | 溶液不变红,试纸不变蓝 | 溶液不变红,试纸褪色 | 生成白色沉淀 |
下列实验分析中,不正确的是
A. ①说明Cl2被完全消耗
B. ②中试纸褪色的原因是:SO2 + I2 + 2H2O == H2SO4 + 2HI
C. ③中若将BaCl2溶液换成Ba(NO3)2溶液,也能说明SO2被Cl2氧化为SO42
D. 实验条件下,品红溶液和SO2均被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是反应A(g) + 3B(g) 2C(g) + 2D(g) 在四种不同情况下的反应速率,反应速率最大的是
A. υ(A)=0.45mol·L-1·s-1B. υ(B)=0.6mol·L-1·s-1
C. υ(C)=0.4mol·L-1·s-1D. υ(D)=0.45mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳经济”已成为全世界科学家研究的重要课题。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
(1)已知:①CO(g)+H2O(g)![]() H2(g)+CO2(g) ΔH=-41 kJ·mol-1
H2(g)+CO2(g) ΔH=-41 kJ·mol-1
②C(s)+2H2(g)![]() CH4(g) ΔH=-73kJ·mol-1
CH4(g) ΔH=-73kJ·mol-1
③2CO(g)![]() C(s)+CO2(g) ΔH=-171 kJ·mol-1
C(s)+CO2(g) ΔH=-171 kJ·mol-1
写出CO2与H2反应生成CH4 和H2O(g)的热化学方程式: __________________。
(2)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,在容积为2L的密闭容器中,充入1 molCO2和3.25 mol H2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如图所示:
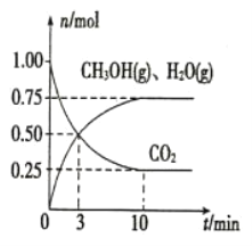
①从反应开始到平衡,氢气的平均反应速率v(H2)=_____________。
②下列措施一定不能使CO2的转化率增大的是_____________(选填编号)。
A.在原容器中再充入1molCO2
B.在原容器中再充入1molH2
C.在原容器中再充入1mol氦气
D.使用更有效的催化剂
E.缩小容器的容积
F.将水蒸气从体系中分离
(3)煤化工通常研究不同条件下CO转化率以解决实际问题。已知在催化剂存在条件下反应:CO(g)+H2O(g)![]() H2(g)+CO2(g)中CO的平衡转化率随
H2(g)+CO2(g)中CO的平衡转化率随![]() 及温度变化关系如图所示:
及温度变化关系如图所示:
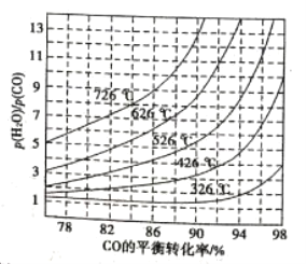
①上述反应的逆反应方向是_____________反应(填“吸热”或“放热”);
②对于气相反应,用某组分(B)的平衡分压(pB)代替平衡浓度(cB)也可以表示平衡常数(记作Kp),则该反应的Kp的表达式为______________,提高![]() ,则Kp_____________(填“变大”、“变小”或“不变”)。使用铁镁催化剂的实际工业流程中,一般采用400 ℃左右、
,则Kp_____________(填“变大”、“变小”或“不变”)。使用铁镁催化剂的实际工业流程中,一般采用400 ℃左右、![]() =3~5,采用此条件的原因可能是___________。
=3~5,采用此条件的原因可能是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】西安北郊古墓中曾出土一青铜锤(一种酒具),表面附着有绿色固体物质,打开盖子酒香扑鼻,内盛有26 kg青绿色液体,专家认定是2000多年前的“西汉美酒”。这是我国考古界、酿酒界的一个重大发现。
(1)上述报道引发了某校化学兴趣小组同学的关注,他们收集家中铜器表面的绿色固体进行探究。
提出问题:铜器表面附着绿色固体物质是由哪些元素组成的?
猜想:查阅相关资料后,猜想绿色固体物质可能是铜绿。
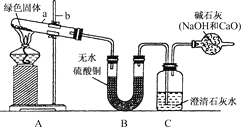
实验步骤:
①对试管内的绿色固体进行加热,至完全分解.观察到A装置中绿色固体逐渐变成黑色,B装置中无水硫酸铜变成蓝色,C装置中澄清石灰水变浑浊.
②取少量加热后生成的黑色固体于试管中,加入稀硫酸.观察到黑色固体逐渐溶解,溶液变成蓝色。
③取少量上述蓝色溶液于试管中,浸入一根洁净的铁丝.观察到铁丝表面有红色物质析出。
④实验结论:绿色固体物质中含有________、________、________、________等元素。(提示:装置内的空气因素忽略不计)
(2)表达与交流:①图中标有a、b的仪器名称是:a:________;b:________。
②上述实验步骤③中发生反应的离子方程式为____________________________。
③反应完成后,如果先移去酒精灯,可能出现的现象是______________________。
④如果将B、C两装置对调行吗?____。为什么?______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物广泛存在于自然界中。回答下列问题:
(1)在基态14C原子中,核外存在______对自旋相反的电子。
(2)碳在形成化合物时,其键型以共价键为主,原因是__________。
(3)CS2分子中,共价键的类型有________,C原子的杂化轨道类型是______,写出两个与CS2具有相同空间构型和键合形式的分子或离子_______。
(4)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:
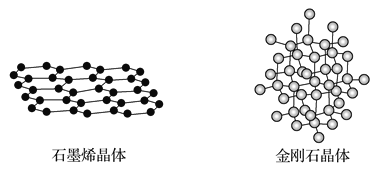
①在石墨烯晶体中,每个C原子连接_____个六元环,每个六元环占有___个C原子。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接_____个六元环,六元环中最多有______个C原子在同一平面。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com