

 Sn(OH)Cl+HCl(2)防止Sn2+被氧化(3)漏斗、玻璃棒、烧杯(4)酸式;71.4%
Sn(OH)Cl+HCl(2)防止Sn2+被氧化(3)漏斗、玻璃棒、烧杯(4)酸式;71.4% Sn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解;(2)由题意知Sn2+易被氧化,加入Sn粉除调节溶液pH外,还防止Sn2+被氧化;(3)由流程图可知,操作Ⅰ是从溶液中得到含结晶水的晶体,只能采取蒸发浓缩、冷却结晶、过滤、洗涤得到,故用到的玻璃仪器为漏斗、玻璃棒、烧杯;(4)碱式滴定管的胶管与重铬酸钾溶液会有一定的氧化和吸附,影响浓度;令锡粉中锡的质量分数为x,则:
Sn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解;(2)由题意知Sn2+易被氧化,加入Sn粉除调节溶液pH外,还防止Sn2+被氧化;(3)由流程图可知,操作Ⅰ是从溶液中得到含结晶水的晶体,只能采取蒸发浓缩、冷却结晶、过滤、洗涤得到,故用到的玻璃仪器为漏斗、玻璃棒、烧杯;(4)碱式滴定管的胶管与重铬酸钾溶液会有一定的氧化和吸附,影响浓度;令锡粉中锡的质量分数为x,则: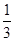 K2Cr2O7计算.
K2Cr2O7计算.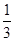 mol
mol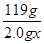 =
=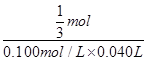


科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 操作 | 现象 | 结论 |
| A. | 滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
| B. | 滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中一定有SO42- |
| C. | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+、无K+ |
| D. | 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中一定无NH4+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 物质 | 杂质 | 所用试剂 | 分离方法 |
| A. | KCl | CaCl2 | Na2CO3溶液、盐酸 | 过滤 |
| B. | CH3CH2OH | CH3COOH | CaO | 蒸馏 |
| C. | NaCl | NH4Cl | NaOH | 蒸干 |
| D. | N2 | O2 | 铜网 | 加热 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用溴水鉴别苯和己烷 |
| B.用BaCl2溶液鉴别SO42-和SO32- |
| C.用浓HNO3与Cu 反应制备NO2 |
| D.将混有HCl的Cl2通入饱和NaHCO3溶液中除去HCl |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
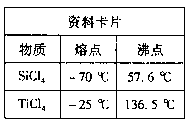


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
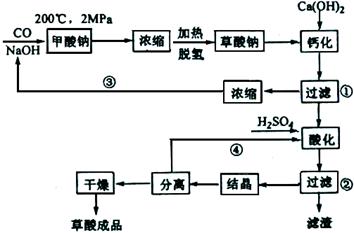
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com