
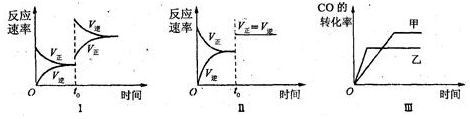
| A. | 图Ⅱ研究的只是t0时使用催化剂对反应速率的影响 | |
| B. | 图Ⅰ研究的是t0时缩小容器体积对反应速率的影响 | |
| C. | 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高 | |
| D. | 图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂 |
分析 图Ⅰt0时正逆反应速率都增大,且逆反应速率大于正反应速率,应为升高温度的影响;
图Ⅱt0时正逆反应速率都增大,且正逆反应速率相等,平衡不移动,应加入催化剂或增大压强的影响;
图Ⅲ乙反应较快,且CO的转化率较低,应是升高温度的影响,以此解答该题.
解答 解:A.反应前后气体的体积不变,压强对平衡移动无影响,图Ⅱt0时正逆反应速率都增大,且正逆反应速率相等,平衡不移动,应加入催化剂或增大压强的影响,故A错误;
B.t0时增大缩小体积,增大压强,平衡不移动,正逆反应速率相等,与图象不符,故B错误;
C.图Ⅲ乙反应较快,且CO的转化率较低,应是升高温度的影响,由图可知乙达到平衡时间较少,如是温度的影响,乙的温度应较高,故C正确;
D.加入催化剂,平衡不移动,正逆反应速率相等,故D错误.
故选C.
点评 本题以图象题的形成综合考查外界条件对平衡移动的影响,注意分析图象中曲线的变化趋势,结合反应的特点进行判断,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 将稀硫酸和碳酸钠反应生成的气体通入一定浓度的Na2SiO3溶液中 | 出现白色胶状沉淀 | 酸性:H2SO4>H2CO3>H2SiO3 |
| B | 向某溶液中滴加氯水后再加入KSCN溶液 | 溶液变为红色 | 溶液中一定含有Fe2+ |
| C | 加热盛有NH4Cl固体的试管 | 试管底部固体消失,试管口有晶体凝结 | NH4Cl固体可以升华 |
| D | 向CuSO4溶液中通入H2S气体 | 溶液的蓝色褪去,生成黑色沉淀 | 氢硫酸 的酸性比硫酸强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5g H2 和 5g O2 | B. | 标况下 5.6L N2和 22g CO2 | ||
| C. | 32 g SO2和0.5molH2 | D. | 44.8 L CO和2NA个O3分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰融化时,分子中H-O键发生断裂 | |
| B. | 原子晶体中,共价键越强,熔点越高 | |
| C. | 分子体中,共价键键能越大,该分子晶体的熔、沸点一定越高 | |
| D. | 分子晶体中,分子间作用力越大,该物质越稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2++2Ag═Cu+2Ag+ | B. | CaCO3+2H+═Ca2++CO2↑+H2O | ||
| C. | 2Fe+6H+═2Fe3++3H2↑ | D. | Ba(OH)2+2H+═Ba2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡是两种或两种以上的物质发生的反应都属于化合反应 | |
| B. | 在反应中,不一定所有元素的化合价都发生变化 | |
| C. | 一种元素被氧化,一定有另一种元素被还原 | |
| D. | 物质只有和氧气发生反应才是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com