
【题目】将4 mol A气体和2 mol B气体在2 L固定体积的容器中混合,并在一定条件下发生如下反应∶2A(g)+B(g)![]() 2C(g)。若经2s后测得C的浓度为0.6 molL-1,
2C(g)。若经2s后测得C的浓度为0.6 molL-1,
求(1)A表示的反应的平均速率?
(2)2 s时物质B的浓度?
(3)2 s时物质A的转化率?
科目:高中化学 来源: 题型:
【题目】工业上采用乙苯脱氢制备苯乙烯,反应体系同时发生两步可逆反应,其能量变化情况如下:

(1)总反应 △H = _______。
△H = _______。
(2)下列叙述不能说明反应体系已达到平衡状态的是___________。
A.v正(CO) = v逆(CO)
B.消耗1 mol CO2同时生成1 mol H2O
C.c(CO2) = c(CO)
D.混合气体的平均相对分子质量保持不变
(3)某化学兴趣小组欲探究在相同压强条件下,CO2用量和温度条件对乙苯脱氢反应
( )的影响,并设计了如下实验:
)的影响,并设计了如下实验:
实验编号 | 乙苯(g) / mol | CO2(g) / mol | He (g) / mol | 温度 / ℃ |
I | 3.0 | 9.0 | 0 | 550 |
Ⅱ | 3.0 | 9.0 | 0 | 600 |
III | 3.0 | 0 | 9.0 | 550 |

①乙苯脱氢反应的化学平衡常数表达式为 。
② 实验III使用9.0molHe的目的是___________________。
③ 经实验测得,三组实验中乙苯的转化随时间变化如图所示。其中未知曲线代表的是实验______(填“
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol某烃在氧气中充分燃烧,需要消耗氧气179.2L(标准状况下)。它在光照的条件下与氯气反应能生成三种不同的一氯取代物。该烃的结构简式是 ( )
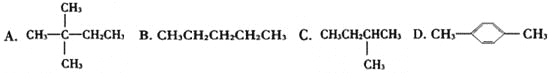
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2SO3易被KMnO4等强氧化剂氧化,现将18mL 0.2mol/L的K2SO3溶液与含有2.4×10-3mol KMnO4溶液混合,正好完全反应。则反应后锰元素的价态为( )
A、+6 B、+4 C、+2 D、+7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学基本概念的判别正确的是:( )
A.氧化还原反应的本质是元素化合价的升降
B.分散系分为溶液、胶体和浊液的依据:分散质微粒直径大小
C.某元素由化合态变为游离态,此元素一定被还原
D.强电解质与弱电解质:溶液的导电能力大小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可用离子交换和滴定的方法。实验中称取0.54g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0mL。计算该样品中氯的物质的量,并求出FeClx中x的值:__________(列出计算过程)。
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe)∶n(Cl)=1∶2.1,则该样品中FeCl3的物质的量分数为__________。在实验室中,FeCl2可用铁粉和__________反应制备,FeCl3可用铁粉和__________反应制备。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大功率的镍氢电池使用在油电混合动力车辆中。镍氢电池NiMH电池正极板材料为NiOOH,负极板材料为吸氢合金,下列关于该电池的说法中正确的的是
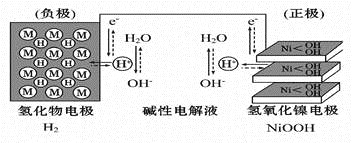
A. 放电时电池内部H+向负极移动
B. 充电时,将电池的负极与外接电源的正极相连
C. 充电时阳极反应为Ni(OH)2+ OH-- e-=NiOOH+H2O
D. 放电时负极的电极反应式为MHn-ne-= M+nH+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食品安全关系国计民生,影响食品安全的因素很多。
(1)聚偏二氯乙烯(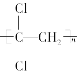 )具有超强阻隔性能,可作为保鲜食品的包装材料。它是由________(写结构简式)发生加聚反应生成的。
)具有超强阻隔性能,可作为保鲜食品的包装材料。它是由________(写结构简式)发生加聚反应生成的。
(2)劣质植物油中的亚油酸[CH3(CH2)4—CH2===CH—CH2—CH===CH—(CH2)7COOH]含量很低。下列关于亚油酸的说法中,正确的是________。
A.分子式为C18H34O2
B.一定条件下能与甘油(丙三醇)发生酯化反应
C.能和NaOH溶液反应
D.能使酸性KMnO4溶液褪色
(3)假酒中甲醇(CH3OH)含量超标,请写出Na和甲醇反应的化学方程式: ___________。
(4)劣质奶粉中蛋白质含量很低。蛋白质水解的最终产物是__________________。
(5)在淀粉中加入吊白块制得的粉丝有毒。淀粉最终的水解产物是葡萄糖。请设计实验证明淀粉已经全部水解,写出操作、现象和结论:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W核电荷数依次增大,X、Z同主族,Z、W同周期,四种元素的原子序数之和为37,在周期表中X是原子半径最小的元素,Y的最外层电子数是内层电子数的3倍。
(1)W在周期表中的位置是第 周期第 族。
(2)X与Y 能形成具有18个电子的化合物,此化合物的电子式为 。
(3)X、Y、Z三种元素组成的化合物中存在 (填“化学键”名称)。
(4)Z单质在W单质中燃烧火焰的颜色是 ;Z单质在空气燃烧生成的物质中,共价键的类型为 ;Y、Z、W形成的某种化合物类型是 化合物(填“共价”或“离子”)。
(5)X和Y形成的化合物沸点 (填“高”或“低”)于X和W形成的化合物沸点。
(6)W单质的水溶液滴入KBr溶液中的现象是 ;Z、W两种元素的最高价氧化物对应水化物溶液之间反应的离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com