
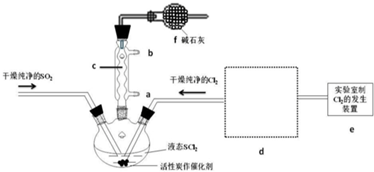
| ���� | �� | �� | �� | �� |
| ����װ�� |  |  |  |  |
| ��ѡ�Լ� | NaHSO3���� | 18.4mol/LH2SO4+Cu | 4mol/LHNO3+Na2SO3 | 70%H2SO4+K2SO3 |
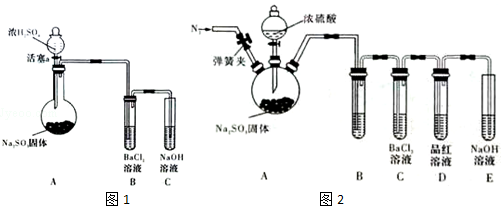
���� ��1����ͼ��֪��������ʯ�������巴Ӧ��
��2��SOCl2��ˮ��Ӧ�ķ���ʽΪ��SOCl2+H2O=SO2��+2HCl����AlCl3��Һ��ˮ�⣬AlCl3•6H2O��SOCl2��ϼ��ȣ�SOCl2��AlCl3•6H2O�еĽᾧˮ���ã�������ˮAlCl3��SO2��HCl���壬SOCl2��ˮ������SO2��HCl����ˮ����������ˮ�ⷢ����
��3�����й�����Һ�巴Ӧ��ȡ��������ȽϺ�������ȡ������Ҫ������������
��4��װ��e�в�����Cl2����d�����������ƿ��d�����������ҳ�ȥHCl��
��5����֪�Ȼ������е�Ϊ77�棬��֪SCl2�ķе�Ϊ50�棬���Բ��÷���ķ������ɽ�֮���룻��������Ϊ$\frac{0.896L}{22.4L/mol}$=0.04mol����SO2+Cl2+SCl2�T2SOCl2������0.08molSOCl2��
��� �⣺��1������c�����������ܣ�f����������һ���Ƿ�ֹ�ж�����������������ݳ���ʵ����Ա�����彡�������в��һ���Ƿ�ֹ�����е�ˮ����������ƿ��ʹ�Ȼ�����ˮ�⣬
�ʴ�Ϊ�����������ܣ������ݳ��ж���Cl2��SO2����ֹ�����е�ˮ�������뷴Ӧװ�ã���ֹSOCl2ˮ�⣻
��2��SOCl2��ˮ��Ӧ�ķ���ʽΪ��SOCl2+H2O=SO2��+2HCl����AlCl3��Һ��ˮ�⣬AlCl3•6H2O��SOCl2��ϼ��ȣ�SOCl2��AlCl3•6H2O�еĽᾧˮ���ã�������ˮAlCl3��SO2��HCl���壬SOCl2��ˮ������SO2��HCl����ˮ����������ˮ�ⷢ����
�ʴ�Ϊ��SOCl2+H2O=SO2��+2HCl����AlCl3��Һ��ˮ�⣬AlCl3•6H2O��SOCl2��ϼ��ȣ�SOCl2��AlCl3•6H2O�еĽᾧˮ���ã�������ˮAlCl3��SO2��HCl���壬SOCl2��ˮ������SO2��HCl����AlCl3ˮ�⣻
��3�����м�������������ȷʵ���������������ͬʱҲ�����ɽ϶��ˮ�������ʼײ�ѡ��
����18.4mol/L������̫Ũ������ˮ�ֹ���������Ȼ�Է�����ʽ���ڣ�����ͭ��Ӧ��ȡ���������Ҳ�ѡ��
����������Ũ���ỹ��ϡ���ᶼ���к�ǿ�������ԣ��������Ľ����������е���4�۵�������Ϊ��6�۵���������Ӷ����õ��������ʱ���ѡ��
���з�Ӧ��������������������ˮ������ȡ��������ȽϺ�����
�ʴ�Ϊ������
��4��װ��e�в�����Cl2����d�����������ƿ��d�����������ҳ�ȥHCl����d�����߿��ڻ�������ʵ��װ��ͼ��������Լ�Ϊ ��
��
�ʴ�Ϊ�� ��
��
��5����֪�Ȼ������е�Ϊ77�棬��֪SCl2�ķе�Ϊ50�棬���Բ��÷���ķ������ɽ�֮���룻��������Ϊ$\frac{0.896L}{22.4L/mol}$=0.04mol����SO2+Cl2+SCl2�T2SOCl2������0.08molSOCl2����SOCl2�IJ���Ϊ$\frac{4.76g}{0.08mol��119g/mol}$��100%=50%��
�ʴ�Ϊ������50%��
���� ���⿼�����ʵ��Ʊ�ʵ�飬�����Ʊ�ʵ�鼰�����ķ�ӦΪ���Ĺؼ���������ѧ���ķ���������ʵ�������Ŀ��飬ע�ⳣ��������Ʊ�ԭ����Ӧ�ã�ע�������Ϣ����ȷ��ȡ�����Ӧ�ã���Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� | HClO2 | HF | HCN | H2S |
| Ka | 1��10-2 | 6.3��10-4 | 4.9��10-10 | K1=9.1��10-8 K2=1.1��10-12 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ����ȩ��
����ȩ��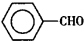 ���������ᣨ
���������ᣨ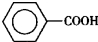 ��������Ҫ�Ļ���ԭ�ϣ������üױ���
��������Ҫ�Ļ���ԭ�ϣ������üױ���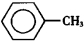 ��Ϊԭ���������±��г����й����ʵIJ����������ʣ���ش�
��Ϊԭ���������±��г����й����ʵIJ����������ʣ���ش�| ���� | ��״ | �۵㣨�棩 | �е㣨�棩 | ����ܶ� ��ˮ=1g/cm3 | �ܽ��� | |
| ˮ | �Ҵ� | |||||
| �ױ� | ��ɫҺ����ȼ�ӷ� | -95 | 110.6 | 0.8660 | ���� | ���� |
| ����ȩ | ��ɫҺ�� | -26 | 179 | 1.0440 | �� | ���� |
| ������ | ��ɫƬ״����״���� | 122.1 | 249 | 1.2659 | �� | ���� |
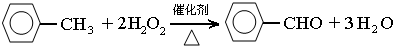 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
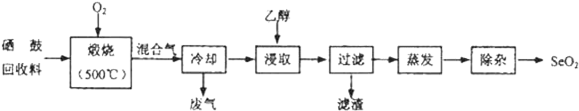
| ���� | �۵� | �е� | �ܽ�� |
| SeO2 | 340�棨315�������� | 684�� | ������ˮ���Ҵ� |
| TeO2 | 733�棨450�������� | 1260�� | ����ˮ���������Ҵ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
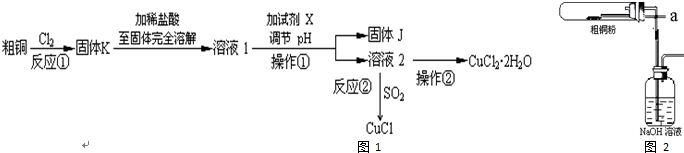
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
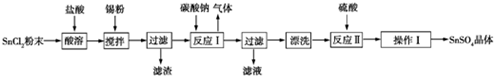
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | �ı������ | ���� |
| A | ���� | CO32-��ˮ��ƽ�������ƶ� |
| B | ����AlCl3���� | ������������ |
| C | ����100mLH2O | ��Һ��c��H+����c��OH-������С |
| D | ��������CH3COONa���� | ��Һ��n��CO32-������ |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com