
| A. | SO2、CO、CO2都是酸性氧化物 | B. | BaSO4、Ca(OH)2、KNO3溶液都是电解质 | ||
| C. | 纯碱、烧碱、碱石灰都是碱 | D. | 稀豆浆、牛奶、淀粉溶液都是胶体 |
分析 A、只能和碱反应生成盐和水的氧化物为酸性氧化物;
B、在水溶液中或熔融状态下能导电的化合物为电解质;
C、电离出的阴离子全部是氢氧根的化合物为碱;
D、分散质粒子直径介于1-100nm之间的分散系为胶体.
解答 解:A、只能和碱反应生成盐和水的氧化物为酸性氧化物,而CO既不能和酸也不能和碱反应生成盐和水,故为不成盐氧化物,故A错误;
B、在水溶液中或熔融状态下能导电的化合物为电解质,而硝酸钾溶液为混合物,故不是电解质,故B错误;
C、电离出的阴离子全部是氢氧根的化合物为碱,而纯碱是碳酸钠,是盐而不是碱,故C错误;
D、分散质粒子直径介于1-100nm之间的分散系为胶体,豆浆、牛奶和淀粉溶液均为胶体,故D正确.
故选D.
点评 本题考查了酸性氧化物和碱性氧化物、电解质和非电解质以及碱和胶体的辨别,难度不大,应注意的是电解质必须是化合物.单质和溶液既不是电解质也不是非电解质.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙烯、苯都既能发生加成反应,也能被酸性高锰酸钾溶液氧化 | |
| B. | 塑料、合成橡胶和合成纤维都属于有机合成高分子化合物 | |
| C. | 淀粉、纤维素、油脂和蛋白质在一定条件下都能发生水解反应 | |
| D. | C4H2Cl8有9种同分异构体(不含立体异构) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钙溶液中通入CO2气体:Ca2++CO2+H2O=CaCO3+2H+ | |
| B. | 以石墨作电极电解氯化铝溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2+Cl2 | |
| C. | 200mL2mol/L的FeBr2溶液中通入11.2L标准状况下的氯气:4Fe2++6Br-+5Cl2=4Fe3++3Br2+10Cl- | |
| D. | 向明矾溶液中加人氢氧化钡溶液至沉淀的物质的量最大:Al3++2SO42-+4OH-=2BaSO4↓+AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32g O2所含的原子数目为2NA | |
| B. | 0.5NA个氯气分子的物质的量是0.5mol | |
| C. | 在标准状况下,22.4 L CH4与18 g H2O所含有电子数均为10NA | |
| D. | 22.4 L的CO气体与1 mol N2所含的电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内压强不再改变 | B. | 水的消耗速率等于氢气的生成速率 | ||
| C. | 气体的密度不再改变 | D. | 反应不再进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 已知A是一种黄绿色气体,由此推断:
已知A是一种黄绿色气体,由此推断:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
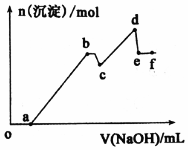 已知25℃时,Ksp[Mg(OH)2]=5.61×l0-12,Ksp[Al(OH)3]=1.3×l0-33,Al(OH)3?AlO2-+H++H2O Ka=6.31×l0-13.某溶液中可能含有 H+、Na+、Mg2+、Al3+、Cl-、HCO3-等离子.向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示.下列有关说法正确的是( )
已知25℃时,Ksp[Mg(OH)2]=5.61×l0-12,Ksp[Al(OH)3]=1.3×l0-33,Al(OH)3?AlO2-+H++H2O Ka=6.31×l0-13.某溶液中可能含有 H+、Na+、Mg2+、Al3+、Cl-、HCO3-等离子.向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示.下列有关说法正确的是( )| A. | b 点沉淀-Al(OH)3;d 点沉淀-A1(OH)3和Mg(OH)2;e点溶质-NaA1O2 | |
| B. | 依据题意,用NaOH不能完全分离Mg2+和Al3+离子 | |
| C. | cd 段发生的反应为:Mg2++2OH-=Mg(OH)2↓ | |
| D. | bc 段发生的反应为:Al(OH)3+OH-=A1O2-+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com