
分析 (1)双氧水体现氧化性说明双氧水中元素化合价仅降低,既体现氧化性又体现还原性说明双氧水中元素化合价既升高又降低;
(2)氧化剂的氧化性>氧化产物的氧化性>还原剂的氧化性;
(3)①根据氧化还原反应中氧化剂和还原剂的特点和性质来寻找反应物和生成物,然后结合化合价升降相等配平;
②根据所发生的反应来分析化合价的变化情况,进而得到转移电子的数目.
解答 解:(1)D中双氧水中氧元素化合价仅降低,说明仅体现氧化性,C中双氧水中氧元素化合价化合价既升高又降低,则既体现氧化性又体现还原性,故答案为:D;C;
(2)反应Ag2O+H2O2=2Ag+O2↑+H2O中,氧化银做氧化剂,双氧水作还原剂,则氧化性Ag2O>H2O2,反应3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O中,双氧水做氧化剂,铬酸钾做氧化产物,则氧化性H2O2>K2CrO4,故氧化性顺序为:Ag2O>H2O2>K2CrO4,
故答案为:Ag2O>H2O2>K2CrO4;
(3)①该反应过程中,高锰酸根的氧化性和双氧水的还原性导致二者间发生氧化还原反应,高锰酸根离子中锰元素从+7变为+2价,化合价降低5价,双氧水中氧元素化合价从-1价变为0价,化合价至少升高2价,则高锰酸根离子的系数为2,双氧水的系数为5,然后利用质量守恒配平可得该反应的离子方程式为:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑,
故答案为:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑;
②上述反应中生成5mol氧气转移电子10mol,当反应中有6.72L(标准状况)即0.3mol氧气生成时,则转移的电子为:10mol×$\frac{0.3mol}{5}$=0.6mol,
故答案为:0.6.
点评 本题考查了氧化还原反应的配平及综合应用,题目难度中等,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及灵活应用能力,注意掌握氧化还原反应的配平方法,明确氧化剂、还原剂的概念及判断方法.


科目:高中化学 来源: 题型:解答题
 甲醇是一种可再生能源,具有广泛的开发和应用前景.
甲醇是一种可再生能源,具有广泛的开发和应用前景.| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(B2-)+c(HB-)=0.1 mol/L | B. | c(B2-)+c(HB-)+c(H2B)=0.1 mol/L | ||
| C. | c(OH-)=c(H+)+c(HB-)+2c(H2B) | D. | c(Na+)+c(OH-)=c(H+)+c(HB-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
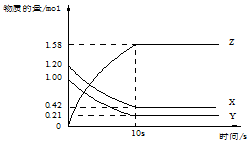 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )| A. | 反应开始到10s,用Z表示的反应速率为0.158mol/(L•s) | |
| B. | 反应开始到10s,X的物质的量浓度减少了0.79mol/L | |
| C. | 反应的化学方程式为:X(g)+Y(g)?Z(g) | |
| D. | 反应开始到10s时,Y的转化率为79.0% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
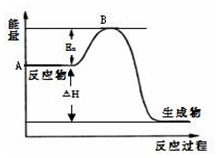 2SO2(g)+O2(g)?2SO3(g)△H=a kJ•mol-1,反应过程的能量变化如图所示.已知1mol SO2(g)完全转化为1mol SO3(g)放热99kJ.请回答:
2SO2(g)+O2(g)?2SO3(g)△H=a kJ•mol-1,反应过程的能量变化如图所示.已知1mol SO2(g)完全转化为1mol SO3(g)放热99kJ.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑦ | B. | ①⑤⑥ | C. | ②③④⑦ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com