
| ||
| A、该反应是氧化还原反应 |
| B、MnO2发生还原反应 |
| C、HCl是还原剂 |
| D、若生成7.1 g Cl2,则转移0.1 mol电子 |
| ||
| 7.1g |
| 71g/mol |


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案科目:高中化学 来源: 题型:
| A、焓变 | B、温度 | C、压强 | D、熵变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知( )
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知( )| A、X、Y、Z中最简单氢化物稳定性最弱的是X |
| B、氧化物对应水化物的酸性Z一定强于Y |
| C、形成的单核阴离子还原性Y强于X |
| D、Z元素单质在化学反应中只表现氧化性,它在水溶液中有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、该反应能量变化类型与CaCO3分解反应相同 |
| B、加催化剂后,正反应速率加快,逆反应速率减少 |
| C、反应热△H=E2-E1 |
| D、若该反应为氧化还原反应,则可以将其设计成原电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、12g石墨烯(单层石墨)中含有六元环的个数为0.5NA |
| B、常温常压下,14g由N2与CO组成的混合气体含有的原子数目为2NA |
| C、已知某种元素的一种原子的质量为 a g,则该元素的相对原子质量近似为a NA |
| D、78 g苯中含有C═C双键的数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸的摩尔质量是98 |
| B、1mol氧的质量等于16g |
| C、摩尔是一个基本物理量 |
| D、以克为单位时,12g12C所含的原子数为阿伏伽德罗常数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③均是氧化还原反应 |
| B、氧化性强弱顺序:K2Cr2O7>Fe2(SO4)3>I2 |
| C、反应②中1mol还原剂失去电子数为6.02×1023 |
| D、反应③中氧化剂与还原剂的物质的量之比为1:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、键角是确定多分子立体结构(分子形状)的重要参数 |
| B、通过反应物和生成物分子中键能数据可以粗略预测反应热的大小 |
| C、键长越长,键能必越小,共价化合物必越稳定 |
| D、同种原子间形成的共价键键长长短总是遵循;叁键<双键<单键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
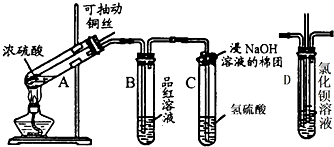
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com