
【题目】在一个固定容积的密闭容器中,保持一定温度进行如下反应:H2(g)+Br2(g)![]() 2HBr(g),已知加入1 mol H2和2 mol Br2达到平衡后,生成x mol HBr,在相同条件下若起始时加入的H2、Br2、HBr分别为a、b、c(均不为0)且保持平衡时,各组分含量都不变,以下推断正确的是
2HBr(g),已知加入1 mol H2和2 mol Br2达到平衡后,生成x mol HBr,在相同条件下若起始时加入的H2、Br2、HBr分别为a、b、c(均不为0)且保持平衡时,各组分含量都不变,以下推断正确的是
①a、b、c应满足的关系是4a+c=2b
②平衡时HBr为ax mol
③a、b、c应满足的关系是a+b=c
④平衡时HBr为![]() x mol
x mol
A. ① B. ①② C. ①④ D. ②③
【答案】C
【解析】
在容器中充入1molH2和2molBr2达到平衡后生成xmolHBr。在相同条件下,若起始时加入H2、Br2、HBr分别为amol、bmol、cmol(均不为0),达到平衡时,各组分百分含量和前一平衡相同,则建立的是等效平衡;由于该反应是气体体积不变的反应,将所有量按照反应方程式转化成氢气和溴,只要满足n(H2):n(Br2)=1mol:2mol=1:2即可。①根据极限转化的思想,将cmol的HBr极限转化为反应物,要实现等效平衡的建立,则相当于的投料符合:氢气:a+![]() =1,溴单质:b+
=1,溴单质:b+![]() =2,整理得到:4a+c=2b,故①正确;②反应两边气体的体积不变,在容器中充入1molH2和2molBr2达到平衡后气体的物质的量还是3mol,则溴化氢的百分含量为
=2,整理得到:4a+c=2b,故①正确;②反应两边气体的体积不变,在容器中充入1molH2和2molBr2达到平衡后气体的物质的量还是3mol,则溴化氢的百分含量为![]() ,加入H2、Br2、HBr分别为amol、bmol、cmol(均不为0),达到平衡时两个平衡中溴化氢的百分含量相等,设达到平衡时HBr物质的量为m,则
,加入H2、Br2、HBr分别为amol、bmol、cmol(均不为0),达到平衡时两个平衡中溴化氢的百分含量相等,设达到平衡时HBr物质的量为m,则![]() =
= ![]() ,所以m=
,所以m=![]() xmol,即达到平衡时HBr物质的量为
xmol,即达到平衡时HBr物质的量为![]() xmol,故②错误,④正确;③根据①可知,4a+c=2b,所以a+b不一定等于c,故③错误;根据分析可知,正确的为①④,故选C。
xmol,故②错误,④正确;③根据①可知,4a+c=2b,所以a+b不一定等于c,故③错误;根据分析可知,正确的为①④,故选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】第四周期中的18种元素具有重要的用途,在现代工业中备受青睐。
(1)铬是一种硬而脆、抗腐蚀性强的金属,常用于电镀和制造特种钢。基态Cr原子中,电子占据最高能层的符号为______,该能层上具有的原子轨道数为________,电子数为________。
(2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的,30Zn与31Ga的第一电离能是否符合这一规律?________(填“是”或“否”),原因是_____________________________________________ (如果前一问填“是”,此问可以不答)。
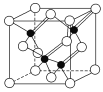
(3)镓与第ⅤA族元素可形成多种新型人工半导体材料,砷化镓(GaAs)就是其中一种,其晶体结构如下图所示(白色球代表As原子)。在GaAs晶体中,每个Ga原子与________个As原子相连,与同一个Ga原子相连的As原子构成的空间构型为________。
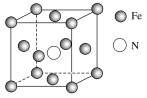
(4)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示,则氮化铁的化学式为________;设晶胞边长为a cm,阿伏加德罗常数为NA,该晶体的密度为________ g·cm-3(用含a和NA的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2017·天津卷)常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A. 增加c(CO),平衡向正向移动,反应的平衡常数增大
B. 第二阶段,Ni(CO)4分解率较低
C. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
D. 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有七种元素,其中A、X、Y、D、E为短周期主族元素,Z、G为第四周期元素,它们的原子序数依次增大。请回答问题。
A | 元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
X | 元素原子的核外 |
Y | 原子的第一至第四电离能分别是: |
D | 原子核外所有 |
E | 元素的主族序数与周期数的差为4 |
Z | 是前四周期中电负性最小的元素 |
G | 在周期表的第七列 |
(1)已知![]() 为离子化合物,写出其电子式_______________。
为离子化合物,写出其电子式_______________。
(2)X基态原子中能量最高的电子,其电子云在空间有______个方向,原子轨道呈_____形;![]() 的空间构型为__________。
的空间构型为__________。
(3)某同学根据上述信息,推断Y基态原子的核外电子排布为:
![]()
该同学所画的电子排布图违背了________________________。
(4)G位于元素周期表的_________区,原子结构示意图为____________________。
(5)![]() 中心原子的杂化方式为_________,其空间构型为____________________。
中心原子的杂化方式为_________,其空间构型为____________________。
(6)Z元素的基态原子价电子排布式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。
(1)溶于海水的CO2主要以4种无机碳形式存在,其中HCO3-占95%,写出CO2溶于水产生HCO3-的方程式:_____________。
(2)在海洋循环中,通过如图所示的途径固碳。
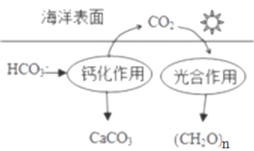
①写出钙化作用的离子方程式:_____________。
②同位素示踪法证实光合作用释放出的O2只来自于H2O,用18O标记物质的光合作用的化学方程式如下,将其补充完整:_____________+_____________=(CH2O)x+x18O2+xH2O,_____________
(3)海水中溶解无机碳占海水总碳的95%以上,其准确测量是研究海洋碳循环的基础,测量溶解无机碳,可采用如下方法:
①气提、吸收CO2,用N2从酸化后的海水中吹出CO2并用碱液吸收(装置示意图如图所示),将虚线框中的装置补充完整并标出所用试剂。_____________

②滴定。将吸收液洗后的无机碳转化为NaHCO3,再用xmol/LHCl溶液滴定,消耗ymLHCl溶液,海水中溶解无机碳的浓度=_____________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验室需要0.2mol/LNaOH溶液500mL和0.5mol/L硫酸溶液450mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是_______(填序号),配制上述溶液还需用到的玻璃仪器是________________________________(填仪器名称)。

(2)现用质量分数为98%、密度为1.84gcm-3的浓硫酸来配制450mL、0.5molL-1的稀硫酸。计算所需浓硫酸的体积为______mL(保留1位小数),现有①10mL ②25mL③50mL ④100mL四种规格的量筒,你选用的量筒是_____(填代号).
(3)配制时,一般可分为以下几个步骤:
①量取②计算③稀释④摇匀⑤转移⑥洗涤⑦定容⑧冷却。其正确的操作顺序
为:②→①→③→___→___→___→___→④(填序号)
(4)在配制过程中,其他操作都准确,下列操作中错误的是_______,能引起误差偏高的有___________(填代号)。
①洗涤量取浓硫酸后的量筒,并将洗涤液转移到容量瓶中
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③将浓硫酸直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓硫酸
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤转移前,容量瓶中含有少量蒸馏水
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
⑦定容时,俯视标线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W.X、Y和Z在周期表中的相对位置如表所示,X原子的最外层电子数与电子层数相同。下列关系正确的是( )
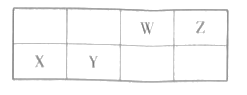
A.简单离子半径:X>W>Z
B.最高价氧化物对应水化物的酸性:Y>W
C.X.Y分别与2形成的二元化合物中化学键相同
D.工业上可用电解熔融的X2Z3制备X单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用一种石油化工产品A(C4H6)为原料合成两种含卤素的有机化合物的合成路线如图。

已知:Ⅰ.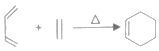 ;
;
II.E的核磁共振氢谱有两个吸收峰且能使溴的四氣化碳溶液褪色;
III.D分子不含甲基,G的分子式为C4H6O,且结构对称。
回答下列问题:
(1)A的系统命名为__,B的结构简式为__。
(2)A→E的反应类型为__,由G和氯水中的某一种成分发生加成反应生成H(不含经基)的化学方程式为__。
(3)下列有关说法正确的是__。
A.烃A的所有原子可能在同一平面上
B.G的一种同分异构体可能发生银镜反应
C.D的结构简式为![]()
D.将nmolA和nmolB通过加聚反应得到高聚物的聚合度为2n
(4)H的同分异构体中含有羧基的结构有__种,写出其中一种在核磁共振氢谱上有2组峰的有机物的结构简式__。
(5)结合上述合成路线中的信息写出以A和乙醇为起始原料合成氯环己烷的路线__。(无机原料自选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年9月起,澳大利亚山火已经持续100多天,产生了大量温室气体。有50mLNaOH溶液,向其中逐渐通入一定量的CO2,然后向溶液中逐滴加入0.1mol/L的稀盐酸,产生的CO2气体体积(标准状况)与所加入的盐酸的体积之间的关系如图所示。下列说法正确的是
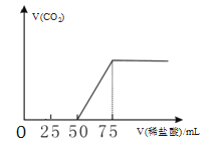
A.滴加盐酸过程中,混合溶液的导电能力不断增强
B.滴加盐酸过程中,混合溶液中c(CO32-)、c(HCO3-)、c(H2CO3)之和不断减小
C.V(稀盐酸)=25mL时,c(H+)+c(H2CO3)=c(CO32-)+c(OH-)
D.V(稀盐酸)=50mL时,c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com