
| A. | HCHO、Al2O3均含有氧元素,属于氧化物 | |
| B. | H2SO4、HNO3均为强酸,属于强电解质 | |
| C. | 蓝宝石、明矾的主要成分都是含有铝元素的氧化物 | |
| D. | AlCl3、Na2O2都属于离子化合物 |
分析 A.两种元素组成其中一种为氧元素的化合物为氧化物;
B.水溶液中完全电离的酸为强酸,属于强电解质;
C.蓝宝石主要成分是氧化铝属于氧化物,明矾是硫酸铝钾晶体属于盐;
D.AlCl3是共价化合物,Na2O2是钠离子和过氧根离子构成的属于离子化合物.
解答 解:A.两种元素组成其中一种为氧元素的化合物为氧化物,Al2O3属于氧化物,HCHO是酸,故A错误;
B.H2SO4、HNO3均在水溶液中完全电离为强酸,属于强电解质,故B正确;
C.蓝宝石主要成分是氧化铝属于氧化物,明矾是硫酸铝钾晶体属于盐,故C错误;
D.AlCl3是共价化合物,Na2O2是钠离子和过氧根离子构成的属于离子化合物,故D错误;
故选B.
点评 本题考查了酸、碱、盐、氧化物、电解质等概念的分析判断,职务基础是解题关键,题目较简单.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
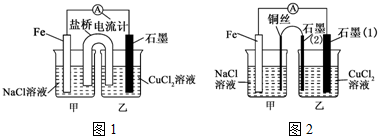
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤ | B. | ①④ | C. | ③⑥ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 “埃博拉”病毒的形状宛如中国古代的“如意”(如图).病毒的基本化学组成是核酸和蛋白质.有的病毒还含有脂质、糖类等其他组分.下列有关有机物的说法不正确的是( )
“埃博拉”病毒的形状宛如中国古代的“如意”(如图).病毒的基本化学组成是核酸和蛋白质.有的病毒还含有脂质、糖类等其他组分.下列有关有机物的说法不正确的是( )| A. | 漂白粉、双氧水都可以杀灭埃博拉病毒 | |
| B. | 组成病毒的糖类、酯类和蛋白质在一定条件下都可发生水解反应 | |
| C. | 酯在酸性条件下的水解反应属于取代反应,也属于可逆反应 | |
| D. | 糖类和蛋白质的燃烧产物不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液和NaOH溶液 | B. | NaAlO2和HCl溶液 | ||
| C. | NaHCO3溶液和HCl溶液 | D. | AgNO3溶液和氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3OH和C3H4 | B. | CH4和C3H4O | C. | CH4和C2H4 | D. | CH4和C3H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,l.6gCH4中含有共价键总数为0.4NA | |
| B. | 常温常压下,2.24 L NO2气体中含有NO2分子数为0.1NA | |
| C. | 1 L0.lmol•L-1的醋酸中含有H十离子数为0.1NA | |
| D. | 铝热反应中1 molFe3O4完全反应,转移的电子数为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com