
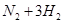


 。
。

 (1分) 减少(1分) ②200℃、100MPa(2分)
(1分) 减少(1分) ②200℃、100MPa(2分) (2分)
(2分) 。正方应是放热反应,升高温度,平衡向逆反应方向移动,所以K值减小。
。正方应是放热反应,升高温度,平衡向逆反应方向移动,所以K值减小。

 英才计划期末调研系列答案
英才计划期末调研系列答案 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源:不详 题型:单选题
 2NH3(g),673 K、30 MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是 ( )。
2NH3(g),673 K、30 MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是 ( )。
| A.点a的正反应速率比点b的小 |
| B.点c处反应达到平衡 |
| C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样 |
| D.其他条件不变,773 K下反应至t1时刻,n(H2)比上图中d点的值大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题


查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.工业上用NaOH溶液来去除MgCl2酸性溶液中的FeCl3 |
| B.氯气和氢气混合在光照条件下生成氯化氢,用水吸收得到盐酸 |
| C.采用高压条件,增大合成氨反应的化学平衡常数,增大原料转化率 |
| D.用Na2CO3溶液浸泡水垢,实现CaSO4向CaCO3的转化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 -锂辉矿(LiAlSi2O6和少量钙镁杂质)反应,生成Li2SO4、MgSO4等,最终制备金属锂。
-锂辉矿(LiAlSi2O6和少量钙镁杂质)反应,生成Li2SO4、MgSO4等,最终制备金属锂。 -锂辉矿与硫酸等物质制备金属锂的工业流程如下图:
-锂辉矿与硫酸等物质制备金属锂的工业流程如下图:
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.工业生产硫酸时,接触室中采用高温高压条件都能提高SO2和O2的转化率 |
| B.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,既能消毒杀菌又能净水 |
| C.阴离子交换树脂可以除去硬水中的Ca2+、Mg2+ |
| D.工业上电解熔融AlCl3可制金属铝 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com