
| A. | 紫色石蕊试液中通入二氧化硫,溶液先变红后褪色 | |
| B. | 将铜片放入浓硫酸中,无明显现象是因为铜片发生了钝化 | |
| C. | 硫粉在过量的纯氧中燃烧可以生成大量的SO3 | |
| D. | 富含硫黄的矿物在工业上可用于制造硫酸 |
分析 A、二氧化硫通入紫色石蕊试液发生反应生成亚硫酸显酸性,溶液变红色;
B、铜和浓硫酸加热发生反应;
C、硫和氧气只能生成二氧化硫,不能生成三氧化硫;
D、富含硫黄的矿物可以煅烧生成二氧化硫,二氧化硫催化氧化生成三氧化硫,三氧化硫溶于水生成硫酸;
解答 解:A、二氧化硫是酸性氧化物,通入紫色石蕊试液发生反应生成亚硫酸显酸性,溶液变红色不能褪色,故A错误;
B、铜和浓硫酸常温下不能发生反应,加热发生反应,不是铜的钝化,故B错误;
C、硫和氧气只能生成二氧化硫不能生成三氧化硫,生成的二氧化硫在催化剂作用下发生反应才能生成三氧化硫,故C错误;
D、富含硫黄的矿物可以煅烧生成二氧化硫,二氧化硫催化氧化生成三氧化硫,三氧化硫溶于水生成硫酸,可以制备硫酸,故D正确;
故选D.
点评 本题考查了二氧化硫性质分析判断,主要是对反应条件、反应产物的理解应用,题目较简单.


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | Ql+Q2<Q3 | B. | Ql+Q2>2Q3 | C. | 2Ql+Q2<4Q3 | D. | 2Ql+Q2>4Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷、甲苯、乙醇、乙酸都可以发生取代反应 | |
| B. | 能发生银镜反应的有机物都是醛 | |
| C. | 乙酸乙酯在无机酸或碱存在时都能发生水解反应 | |
| D. | 可用浓溴水来区分乙醇和苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
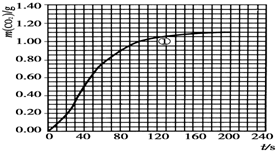 某探究小组用HNO3与大理石反应过程中质量减小的方法研究影响反应速率的因素.所用HNO3浓度为1.00mol•L-1、2.00mol•L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO3用量为25.0mL,大理石用量为10.00g.
某探究小组用HNO3与大理石反应过程中质量减小的方法研究影响反应速率的因素.所用HNO3浓度为1.00mol•L-1、2.00mol•L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO3用量为25.0mL,大理石用量为10.00g.| 实验编号 | T/K | 大理石规格 | HNO3浓度/mol•L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究HNO3的浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究大理石规格 (粗、细)对该反应速率 的影响. |
| ② | ||||
| ③ | ||||
| ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
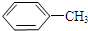 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$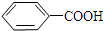
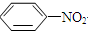 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$
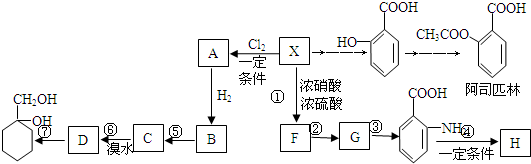
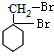 ,G
,G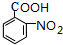 .
.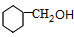 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$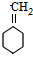 +H2O.
+H2O.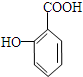 与碳酸氢钠溶液反应:
与碳酸氢钠溶液反应: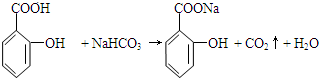 .
.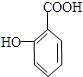 有多种同分异构体,其中属于芳香族化合物的同分异构体不可能为下列中的ad.
有多种同分异构体,其中属于芳香族化合物的同分异构体不可能为下列中的ad.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | 只有③ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | Z | |
| W | M | Q |
| A. | W的最高价氧化物可以和Z的氢化物反应 | |
| B. | X、Y、Z三种元素的原子半径由大到小的顺序为Z>Y>X | |
| C. | X的含10个电子的气态氢化物可以与X的最高价氧化物对应的水化物溶液反应生成盐 | |
| D. | 工业上电解Q元素的钠盐溶液可获得一种含Q元素的消毒剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com