
| A�� | ̽��Na��ˮ��Ӧ������O2���� | |
| B�� | ̽��Na2O2��SO2��Ӧ������Na2SO4���� | |
| C�� | ̽��Ũ������ͭ��һ�������·�Ӧ�����ĺ�ɫ�����п��ܺ���CuS | |
| D�� | ̽������з�̪��NaOH��Һ��ͨ��Cl2����Һ��ɫ��ȥ��ԭ������Һ����Ըı����£�����HClO��Ư�������� |
���� A��ͬһ������ԭ��Ӧ���еõ��ӵ�Ԫ��Ҳ��ʧ���ӵ�Ԫ�أ�
B������������л�ԭ�ԡ��������ƾ��������ԣ�
C��Ũ������ͭ����������ԭ��Ӧ�������е���ԭ��ͭ�п��ܱ�����Ϊ��ͭ��
D������û��Ư���ԣ��������������ƾ���Ư���ԣ�������Һ��ʹ��̪��Һ���ɫ��
��� �⣺A�����������غ㶨�ɣ���ѧ��Ӧǰ��Ԫ�ص�����䣬�ƺ�ˮ�к�����Ԫ�ء���Ԫ�غ���Ԫ�أ��²�������������Ϊ������������������ԭ��Ӧ�Ļ������ɣ����ǻ�ԭ����ˮֻ������������Ԫ�ػ��ϼ���Ҫ���ͣ���Ԫ��������ͼ�-2�ۣ��������ٽ��ͣ���Aѡ��
B������������л�ԭ�ԣ��������ƾ��������ԣ����Կ���̽��SO2��Na2O2��Ӧ������Na2SO4���ɣ���B��ѡ��
C������������ԭ��Ӧ���ϼ۱仯��Ũ������ͭ��Ӧ�������е���Ԫ�ر���ԭ��ͭ�п��ܱ�����Ϊ��ͭ����̽�����壬��C��ѡ��
D���������������Ʒ�Ӧ�����Ȼ��ƴ������ƺ�ˮ����������������Һ��ɫ��ȥ������������ˮ��Ӧ���ɵĴ���������ɵĴ�������ˮ�����ɴ��������Ư���ԣ���̽�����壬��D��ѡ��
��ѡA��
���� ���⿼�黯ѧʵ�鷽�����ۣ�Ϊ��Ƶ���㣬�漰������ɷ��Ʋ⣬��ȷ������ԭ��Ӧ���ɡ��������ʵ�֪ʶ���ǽⱾ��ؼ���ע��������ԭ��Ӧ�ص㼰���ʣ���Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Mg��AlΪ�缫��NaOH��ҺΪ�������Һ��ԭ����У�����������NA�����ӣ��������ų�H2�����Ϊ11.2 L | |
| B�� | ���³�ѹ�£�2.8g����ϩ�ͱ�ϩ�Ļ�������к�̼̼˫������ĿΪ0.1NA | |
| C�� | ������1 L 0.5mol/L NH4Cl��Һ��2L 0.25mol/L NH4Cl��Һ����NH4+����Ŀ��Ϊ0.5NA | |
| D�� | �����£�16.8 g Fe������ˮ������ȫ��Ӧʧȥ0.8NA������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
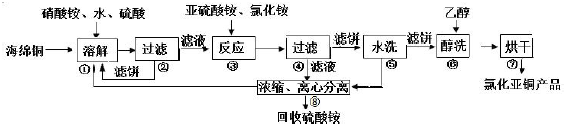
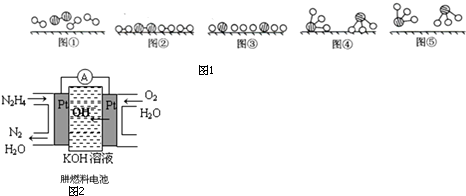
 ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

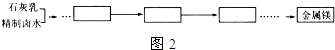
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
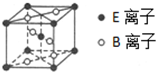 A��B��C��D��EΪ�˵�����������������Ԫ�أ�A�Ļ�̬ԭ������2��δ�ɶԵ��ӣ�B�ǵؿ��к�������Ԫ�أ�C�Ƕ�����������õĽ���Ԫ�أ�D��C���γ�CD�����ӻ����E�Ļ�̬ԭ��3d�������2�����ӣ���ش��������⣺
A��B��C��D��EΪ�˵�����������������Ԫ�أ�A�Ļ�̬ԭ������2��δ�ɶԵ��ӣ�B�ǵؿ��к�������Ԫ�أ�C�Ƕ�����������õĽ���Ԫ�أ�D��C���γ�CD�����ӻ����E�Ļ�̬ԭ��3d�������2�����ӣ���ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | ͭ�к��д������л���ɲ������յķ�����ȥ�л��� | |
| B�� | ���պ�������ͭ�Ŀ���ԭ���Ǹ�������ͭ������������ | |
| C�� | ͨ��;����ʵ���ô�������ͭ��ȡ������������е�ʵ��������裺���ܡ�����ͨ���������ˡ���������ȴ�ᾧ�����ˡ���Ȼ���� | |
| D�� | ��;��II��ȣ����������ĵ���;��I���������٣�;��I���������Ⱦ���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ȼ������ˮ�ʼ��Ե�ԭ�������к��н϶��Mg2+��Ca2+������ | |
| B�� | ʳ�õع��Ͷ������Σ������ԭ����Ҫ�����溬�л���ù�غ������� | |
| C�� | ������CH4��CO2�����庬����������������ЧӦ�������������������� | |
| D�� | ����Ĥ��һ����ʳƷ������Ҫ�ɷ��Ǿ�����ϩ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
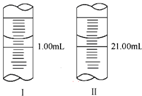 ������ѧ���ò����ƾ��壨Na2C2O4��Һ��ɫ����Ϊ�����ʲⶨ����KMnO4��Һ��Ũ�ȣ�
������ѧ���ò����ƾ��壨Na2C2O4��Һ��ɫ����Ϊ�����ʲⶨ����KMnO4��Һ��Ũ�ȣ��鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com