
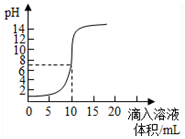
| A. | 原来盐酸的物质的量浓度为0.1mol•L-1 | |
| B. | 可以选择红色石蕊作为指示剂 | |
| C. | 氢氧化钠的物质的量浓度为0.1mol•L-1 | |
| D. | pH为7时加入的氢氧化钠的物质的量为0.1mol |
分析 A.未加NaOH溶液时盐酸pH=1,HCl是强电解质,则c(HCl)=c(H+)=10-pH;
B.石蕊试液的变色范围是5-8;
C.HCl、NaOH都是强电解质,二者完全反应时物质的量之比为1:1,所以溶液pH=7时二者恰好完全反应,则c(HCl).V(HCl)=c(NaOH).V(NaOH);
D.pH=7时n(NaOH)=n(HCl).
解答 解:A.未加NaOH溶液时盐酸pH=1,HCl是强电解质,则c(HCl)=c(H+)=10-pH=10-1 mol/L=0.1mol/L,故A正确;
B.石蕊试液的变色范围是5-8,滴定终点时颜色变化不明显,应该用酚酞作指示剂,故B错误;
C.HCl、NaOH都是强电解质,二者完全反应时物质的量之比为1:1,所以溶液pH=7时二者恰好完全反应,则c(HCl).V(HCl)=c(NaOH).V(NaOH),所以c(NaOH)=$\frac{0.1mol/L×0.1L}{0.01L}$=1mol/L,故C错误;
D.pH=7时n(NaOH)=n(HCl)=0.1mol/L×0.1L=0.01mol,故D错误;
故选A.
点评 本题考查酸碱混合溶液定性判断,侧重考查学生图象分析及计算能力,明确图象中拐点、曲线变化含义是解本题关键,易错点是指示剂的选取,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
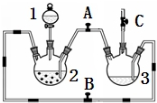 某化学兴趣小组拟用如图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁屑、稀硫酸、氢氧化钠溶液.
某化学兴趣小组拟用如图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁屑、稀硫酸、氢氧化钠溶液.| 实验次数 | 第一次 | 第二次来 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷在O2中燃烧的反应 | B. | Ba(OH)2•8H2O与NH4Cl的反应 | ||
| C. | 灼热的碳与H2O(g)反应 | D. | 铝片与稀H2SO4反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水与少量苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| B. | 过氧化钠溶于水:2022-+2H2O═4OH-+O2↑ | |
| C. | 将过量二氧化硫气体通入氨水中:SO2+NH3•H2O═HSO3-+NH4+ | |
| D. | 向Ba(OH)2溶液中滴加稀硫酸:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的 |
| A. | 可逆反应FeCl3(aq)+3KSCN(aq)?Fe(SCN)3(aq)+3KCl(aq)建立平衡后,在其它条件不变时,加入KCl固体,观察体系颜色的变化. | 验证浓度对化学平衡的影响 |
| B. | 相同温度下,将等质量的大理石块、大理石粉末分别加入等体积、等浓度的盐酸和硫酸中,观察气泡产生的快慢. | 验证固体接触面积对化学反应速率的影响 |
| C. | 相同温度下,两只试管中装有等体积、等浓度的H2O2溶液,向其中分别加入少量FeCl3固体和少量MnO2固体. | 验证不同催化剂对H2O2分解速率的影响 |
| D. | 将SO2气体通入溴水中,观察溶液颜色的变化 | 证明SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 回答下列问题:
回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com