
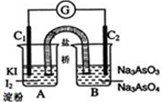
 将可逆反应:AsO43-+2I-+2H+?AsO33-+I2+H2O设计成如图所示的电化学装置,其中C1、C2均为碳棒.回答下列问题:
将可逆反应:AsO43-+2I-+2H+?AsO33-+I2+H2O设计成如图所示的电化学装置,其中C1、C2均为碳棒.回答下列问题:分析 (1)若向右侧B烧杯中加入浓盐酸酸化,则右侧B烧杯中发生AsO43-+2e-+2H+?AsO33-+H2O,则C2为正极,C1为负极,该极上的电极反应式为2I--2e-=I2;外电路中电子的流动方向为负极→导线→正极,据此分析;
(2)若向右侧B烧杯中加入40%NaOH溶液,则C2电极上的电极反应式为AsO33--2e-+2OH-=AsO43-+H2O;
(3)a.向该装置中的B烧杯中加入盐酸,发生AsO43-+2e-+2H+?AsO33-+H2O,则C2为正极,C1为负极,加入40%NaOH溶液,发生AsO33--2e-+2OH-=AsO43-+H2O,则C1为正极,C2为负极;
b.向B烧杯中加入40%NaOH溶液,发生AsO33--2e-+2OH-=AsO43-+H2O,则C1为正极,C2为负极,则盐桥中的阳离子移向正极;
c.因为可逆反应,所以向B烧杯中加入足量NaOH,最终A烧杯中仍然会有碘单质存在;
解答 解:(1)若向右侧B烧杯中加入浓盐酸酸化,则右侧B烧杯中发生AsO43-+2e-+2H+?AsO33-+H2O,则C2为正极,C1为负极,该极上的电极反应式为2I--2e-=I2,所以A烧杯中溶液颜色变深;外电路中电子的流动方向为负极C1→导线→正极C2;故答案为:负;2I--2e-=I2;C1;C2;变深;
(2)若向右侧B烧杯中加入40%NaOH溶液,则C2电极上的电极反应式为AsO33--2e-+2OH-=AsO43-+H2O;故答案为:AsO33--2e-+2OH-=AsO43-+H2O;
(3)a.向该装置中的B烧杯中加入盐酸,发生AsO43-+2e-+2H+?AsO33-+H2O,则C2为正极,C1为负极,加入40%NaOH溶液,发生AsO33--2e-+2OH-=AsO43-+H2O,则C1为正极,C2为负极,所以外电路中均可检测到电子,但电流方向不同,故错误;
b.向B烧杯中加入40%NaOH溶液,发生AsO33--2e-+2OH-=AsO43-+H2O,则C1为正极,C2为负极,则盐桥中的阳离子移向正极A烧杯,故正确;
c.因为可逆反应,所以向B烧杯中加入足量NaOH,最终A烧杯中仍然会有碘单质存在,所以最终A烧杯中溶液蓝色不会褪去,故错误;
故选:b.
点评 本题主要考查了原电池的设计与原理的应用,难度不大,注意正负极反应的本质,电极方程式的书写是难点.


科目:高中化学 来源: 题型:选择题
| A. | 混合物--液氯、漂白粉 | B. | 碱性氧化物--Al2O3、Na2O2 | ||
| C. | 强电解质--NH4Cl、HClO | D. | 非电解质--NH3、SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol | B. | 1mol | C. | 2.25 mol | D. | 2.5 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入有色布条,有色布条褪色,说明溶液中有氯气分子存在 | |
| B. | 溶液呈现黄绿色,且有刺激性气味,说明有氯气分子存在 | |
| C. | 先加入盐酸酸化,再加入硝酸银溶液产生白色沉淀,说明有Cl-存在 | |
| D. | 加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤⑦ | B. | ②③⑥ | C. | ②④ | D. | ②④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池的正极和电解池的阴极所发生的反应分别是氧化反应、还原反应 | |
| B. | 温度不变,用惰性电极电解饱和碳酸钠溶液,通电一段时间,溶液的浓度不变,有晶体析出 | |
| C. | 用惰性电极电解CuCl2溶液,一段时间后,要恢复原来的浓度,应加入固体CuSO4 | |
| D. | 以惰性电极电解CuSO4溶液,若阳极上产生的气体的物质的量为0.010mol,则阴极上析出Cu的质量为12.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阳极反应为Fe-2e-═Fe2+ | |
| B. | 过程中有Fe(OH)3沉淀生成 | |
| C. | 电路中每转移12mol电子,最多有1molCr2O72-被还原 | |
| D. | 如果石墨做阴阳极,电解过程不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用溶解、过滤的方法出去CaO中的CaCO3杂质 | |
| B. | 用结晶法提纯NaCl和KNO3混合物中的KNO3 | |
| C. | 用蒸馏法分离乙醇和乙酸(沸点分别为78℃、118℃)的混合物 | |
| D. | 用萃取和分液的方法可以分离碘和水的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com