
| A. | 向待测液里加入NaOH溶液,产生红褐色沉淀,则待测液中肯定含有Fe3+ | |
| B. | 向待测液里加入BaCl2溶液,若产生白色沉淀,再加入过量稀硝酸白色沉淀不溶解,则表明待测液中肯定含有SO42- | |
| C. | 向待测液里加入过量硝酸无现象,再加入硝酸银溶液,若无沉淀生成,则表明待测液中肯定不含Cl- | |
| D. | 向待测液里加入CaCl2溶液,不产生白色沉淀,加入稀盐酸产生无色无味气体,该气体通入澄清石灰水中,溶液变浑浊,则表明待测液中肯定含HCO3- |
分析 A.红褐色沉淀为氢氧化铁;
B.白色沉淀可能为AgCl或硫酸钡,或亚硫酸钡;
C.若含氯离子,生成AgCl不溶于硝酸;
D.该无色无味气体通入澄清石灰水中,溶液变浑浊,气体为二氧化碳.
解答 解:A.红褐色沉淀为氢氧化铁,可知待测液中肯定含有Fe3+,故A正确;
B.白色沉淀可能为AgCl或硫酸钡,或亚硫酸钡,不能说明待测液中肯定含有SO42-,应先加盐酸排除干扰离子,再加BaCl2溶液,若产生白色沉淀,可检验,故B错误;
C.若含氯离子,生成AgCl不溶于硝酸,则待测液里加入过量硝酸无现象,再加入硝酸银溶液,若无沉淀生成,则表明待测液中肯定不含Cl-,故C正确;
D.该无色无味气体通入澄清石灰水中,溶液变浑浊,气体为二氧化碳,则待测液里加入CaCl2溶液,不产生白色沉淀,加入稀盐酸产生无色无味气体,可知待测液中肯定含HCO3-,故D正确;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质的性质、离子检验等,把握物质的性质、离子检验的试剂及现象为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:选择题
| A. | CH≡CH | B. | CH≡C-CH3 | C. | CH2═CH2 | D. | CH2═C(CH3)CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S是氧化剂,NaOH是还原剂 | |
| B. | Na2S是还原产物,H2O是氧化产物 | |
| C. | 氧化剂与还原剂的物质的量之比为1:2 | |
| D. | 氧化剂与还原剂的物质的量之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 取一张用饱和NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现 a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色.则下列说法正确的是( )
取一张用饱和NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现 a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色.则下列说法正确的是( )| A. | 电解过程中水是还原剂 | B. | 电解过程中Cl-被还原 | ||
| C. | a 电极与电源负极相连 | D. | b电极附近溶液的碱性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
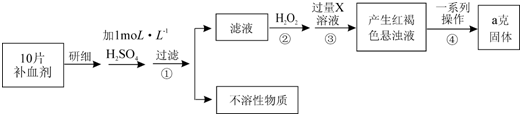
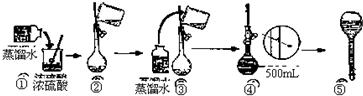
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入适量的CO2 | B. | 加入过量的BaCl2溶液 | ||
| C. | 加入适量的稀盐酸 | D. | 加入过量的稀硝酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com