
| A. | 1869年俄国科学家门捷列夫发现元素周期律 | |
| B. | 1803年英国科学家道尔顿建立原子学说 | |
| C. | 1771年法国科学家拉瓦锡建立氧化学说 | |
| D. | 1661年英国科学家波义耳提出了化学元素的概念 |
科目:高中化学 来源: 题型:选择题
| A. | 能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42-、S2-、SO32- | |
| B. | 有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- | |
| C. | 碳酸氢钠溶液中:K+、ClO-、Cl-、OH- | |
| D. | 使酚酞变红的溶液中:CO32-、Na+、AlO2-、NO3-、S2-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠着火时使用泡沫灭火器灭火 | |
| B. | 用试管加热碳酸氢钠固体时使试管口竖直向上 | |
| C. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 | |
| D. | 做蒸馏实验时,如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K1=16 | B. | K1=8 | C. | K2=1 | D. | K2=0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
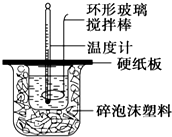 某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:| 实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差 (t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点:Br2>Cl2>F2 | B. | 氧化性:Cl2>Br2>I2 | ||
| C. | 酸性:HClO4>HBrO4>HIO4 | D. | 稳定性:HI>HBr>HCl>HF |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com