
分析 (1)①焦炭在高温下可以置换二氧化硅中的硅;
②根据熔沸点的不同实现物质分离的方法为蒸馏或分馏;所用到的玻璃仪器除酒精灯、温度计、锥形瓶外还需要蒸馏烧瓶和冷凝管;
(2)具有磁性的黑色材料含有某种铁的氧化物即Fe3O4,与稀硫酸溶液反应生成硫酸铁、硫酸亚铁和水;根据KSCN溶液与三价铁离子显血红色检验;
(3)氧化铝是两性氧化物,既能和强酸反应又能和强碱反应,均放出氢气;
(4)根据AlFe(OH)nCl6-n中各元素的化合价代数和为0计算;
(5)因为铝与氢氧化钠溶液反应生成氢气,而镁不反应,所以90ml氢气为铝与氢氧化钠溶液反应生成,又铝和镁都能与盐酸反应生成氢气,所以100ml氢气为铝和镁与盐酸反应生成,据此计算;
(6)反应中氯气是自身氧化还原反应,化合价从0价变化为-1价和+1价,依据原子守恒和得失电子守恒解答.
解答 解:(1)①工业上用焦炭在高温下置换二氧化硅中的硅来制备粗硅,方程式为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,故答案为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
②SiHCl3(沸点33.0℃)、SiCl4(沸点57.6℃)、HCl(沸点-84.7℃),他们的沸点不同,根据沸点的不同实现物质分离的方法为蒸馏或分馏,所用到的玻璃仪器除酒精灯、温度计、锥形瓶外还需要蒸馏烧瓶和冷凝管;故答案为:蒸馏或分馏;蒸馏烧瓶和冷凝管;
(2)具有磁性的黑色材料含有某种铁的氧化物即Fe3O4,与稀硫酸溶液反应生成硫酸铁、硫酸亚铁和水,方程式为:Fe3O4+4H2SO4═FeSO4+Fe2(SO4)3+4H2O;因为三价铁离子遇KSCN溶液显血红色,所以检验三价铁离子的实验操作方法是取少量该溶液于试管中,滴入几滴KSCN溶液,溶液变为红色,说明溶液中含有Fe3+;
故答案为:Fe3O4+4H2SO4═FeSO4+Fe2(SO4)3+4H2O;取少量该溶液于试管中,滴入几滴KSCN溶液,溶液变为红色,说明溶液中含有Fe3+;
(3)氧化铝是两性氧化物,既能和强酸反应又能和强碱反应,离子方程式分别为:Al2O3+6H+═2Al3++3H2O、Al2O3+2OH-═2AlO2-+H2O;
故答案为:Al2O3+6H+═2Al3++3H2O、Al2O3+2OH-═2AlO2-+H2O;
(4)化合物中铝元素显+3价,氢氧根为-1价,氯元素为-1价,各元素的化合价代数和为0,故铁元素的化合价为+3价,故答案为:+3;
(5)因为铝与氢氧化钠溶液反应生成氢气,而镁不反应,所以90ml氢气为铝与氢氧化钠溶液反应生成,又铝和镁都能与盐酸反应生成氢气,所以100ml氢气为铝和镁与盐酸反应生成,根据得失电子守恒,则铝生成90ml氢气,镁生成100-90=10ml氢气,所以合金中镁,铝的质量之比为10×24:90×$\frac{2}{3}$×27=4:27,故答案为:4:27;
(6)反应中氯气是自身氧化还原反应,化合价从0价变化为-1价和+1价,依据原子守恒进而电子守恒得到,反应物缺项为H2O,配平的化学方程式为:2Cl2+2Na2CO3+H2O=2NaHCO3+2NaCl+Cl2O,
故答案为:2;2;H2O;2;2;1.
点评 本题考查了有关硅的无机推断、实验方案设计的有关知识,考查的知识点范围较广,题目难度中等,掌握实验原理的解题的关键,注意常用化学用语的书写.


 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫元素的质量比为5:4 | B. | 任何情况下体积比均为1:1 | ||
| C. | 含有的O2、O3两分子数之比为1:1 | D. | SO2、SO3两分子数之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
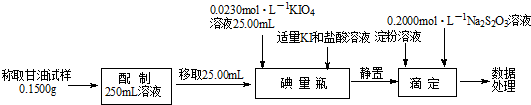
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
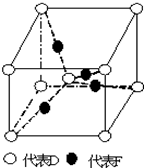 在周期表中1~36号之间的A、B、C、D、E、F六种元素,它们的原子序数依次增大,已知A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C元素原子的最外层有3个自旋方向相同的未成对电子,D原子核外电子有8种不同的运动状态,E元素在第四周期,E的基态原子中未成对电子数是核外电子总数的$\frac{1}{4}$,F元素位于周期表的ds区,其基态原子最外能层只有一个电子.
在周期表中1~36号之间的A、B、C、D、E、F六种元素,它们的原子序数依次增大,已知A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C元素原子的最外层有3个自旋方向相同的未成对电子,D原子核外电子有8种不同的运动状态,E元素在第四周期,E的基态原子中未成对电子数是核外电子总数的$\frac{1}{4}$,F元素位于周期表的ds区,其基态原子最外能层只有一个电子. .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
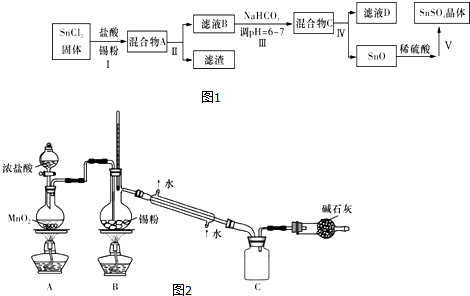
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
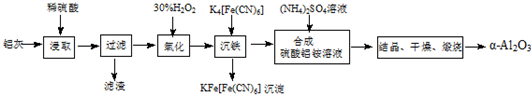
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com