
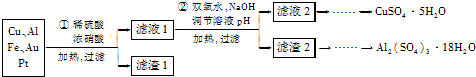
分析 本题是以含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物制备硫酸铜和硫酸铝晶体的流程,首先在稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成Cu2+、Al3+、Fe2+,过滤除去少量Au、Pt;在滤液1中用绿色氧化剂过氧化氢氧化二价铁离子得到三价铁,然后通过调整溶液的pH使Fe3+、Al3+沉淀,过滤得到滤液2结晶,得到硫酸铜晶体,滤渣2为氢氧化铁和氢氧化铝的混合物,先用氢氧化钠溶液溶解氢氧化铝沉淀,过滤得到偏铝酸钠溶液,再通人二氧化碳至不再有沉淀析出,过滤、用水洗涤固体2-3次得纯净的氢氧化铝沉淀,将固体转移到烧杯中,用硫酸溶解,蒸发浓缩、冷却结晶,得到硫酸铝晶体,
(1)稀硫酸、浓硝酸混合酸后加热,Cu与浓硝酸发生反应生成Cu2+、NO2和H2O;
(2)过氧化氢具有氧化性且被还原为水,无杂质无污染,可以氧化亚铁离子为铁离子易于沉淀除去;
(3)①有碘参加反应,因此可以选用淀粉溶液作指示剂,根据滴定终点的判断方法分析;
②CuSO4溶液与KI反应,铜离子被I-还原为亚铜离子,碘离子被氧化为I2,据此书写离子方程式;
③根据方程式可知20.00mL溶液中n(CuSO4•5H2O)=n(EDTA)=c×6×10-3mol结合w=$\frac{m(CuSO{\;}_{4}•5H{\;}_{2}O)}{m(总)}$×100%计算;
(4)根据以上分析,滤渣2为氢氧化铁和氢氧化铝的混合物,先用氢氧化钠溶液溶解氢氧化铝沉淀,过滤得到偏铝酸钠溶液,再通人二氧化碳至不再有沉淀析出,过滤、用水洗涤固体2-3次得纯净的氢氧化铝沉淀,将固体转移到烧杯中,用硫酸溶解,蒸发浓缩、冷却结晶,得到硫酸铝晶体;
解答 解:本题是以含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物制备硫酸铜和硫酸铝晶体的流程,首先在稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成Cu2+、Al3+、Fe2+,过滤除去少量Au、Pt;在滤液1中用绿色氧化剂过氧化氢氧化二价铁离子得到三价铁,然后通过调整溶液的pH使Fe3+、Al3+沉淀,过滤得到滤液2结晶,得到硫酸铜晶体,滤渣2为氢氧化铁和氢氧化铝的混合物,先用氢氧化钠溶液溶解氢氧化铝沉淀,过滤得到偏铝酸钠溶液,再通人二氧化碳至不再有沉淀析出,过滤、用水洗涤固体2-3次得纯净的氢氧化铝沉淀,将固体转移到烧杯中,用硫酸溶解,蒸发浓缩、冷却结晶,得到硫酸铝晶体,
(1)稀硫酸、浓硝酸混合酸后加热,Cu与浓硝酸发生反应生成Cu2+、NO2和H2O,离子反应为:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O;故答案为:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O;
(2)双氧水作氧化剂把Fe2+氧化为Fe3+;故答案为:把Fe2+氧化为Fe3+;
(3)①有碘参加反应,因此可以选用淀粉溶液作指示剂,根据滴定终点的判断方法,要求蓝色刚好褪去,且半分钟内不恢复蓝色;故答案为:淀粉溶液;蓝色刚好褪去,且半分钟内不恢复蓝色;
②铜离子被I-还原为亚铜离子,碘离子被氧化为I2,根据原子守恒和得失电子守恒书写离子方程式为;2Cu2++4I-═2CuI↓+I2;故答案为:2Cu2++4I-═2CuI↓+I2;
③根据方程式可知20.00mL溶液中n(CuSO4•5H2O)=n(EDTA)=c×6×10-3mol;所以m(CuSO4•5H2O)=c×6×10-3mol×250g/mol=1.5c g,因此100mL溶液中CuSO4•5H2O的质量为:1.5c×5=7.5cg,所以w=$\frac{7.5cg}{ag}$×100%=$\frac{7.5c}{a}$×100%,故答案为:$\frac{7.5c}{a}$×100%;
(4)根据以上分析,滤渣2为氢氧化铁和氢氧化铝的混合物,先用氢氧化钠溶液溶解氢氧化铝沉淀,过滤得到偏铝酸钠溶液,再通人二氧化碳至不再有沉淀析出,过滤、用水洗涤固体2-3次得纯净的氢氧化铝沉淀,将固体转移到烧杯中,用硫酸溶解,蒸发浓缩、冷却结晶,得到硫酸铝晶体;故答案为:氢氧化钠溶液;通人二氧化碳至不再有沉淀析出,过滤、用水洗涤固体2-3次,将固体转移到烧杯中,用硫酸溶解,蒸发浓缩、冷却结晶.
点评 本题考查离子分离的方法,实验设计,试剂选择,中和滴定的简单计算和误差的分析,离子性质的熟练掌握是解题关键,题目难度中等.


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:解答题
 “低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用.试回答下列问题:
“低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 磷酸的摩尔质量(以g/mol为单位)与NA 个磷酸分子的质量(以g为单位)在数值上相等 | |
| B. | NA个氮分子和NA个氢分子的质量比等于14:1 | |
| C. | 1 mol CH3+(碳正离子)中含有电子数为10 NA | |
| D. | 32g氧气所含的氧原子数目为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成份 | 浓度/(mol•L-1) | 质量分数 |
| HCl FeCl2 FeCl3 | -- 1.920 0.071 | 5.00% 8.94% 0.33% |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,23gNO2与N2O4的混合物中含有NA个氧原子 | |
| B. | 一定条件下,1.4g N2和0.2mol H2混合充分反应,转移的电子数为0.3NA | |
| C. | 标准状况下,40g三氧化硫体积约为11.2L | |
| D. | 1L1mol•L?1的Na2CO3 溶液中阴离子数目小于NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L 氟化氢中含2NA个原子 | |
| B. | 0.1mol/L的Na2CO3溶液含有CO32-的数目为0.1NA | |
| C. | 6.0g金刚石含有C-C键的数目为NA | |
| D. | 氢氧燃料电池正极消耗22.4 L气体时,电路中通过电子的数目为4 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com