
下列各轨道能量由低到高排列的是 ( )
A.1s 2P 3S 3d B.2s 2px 2py 2pz C.1s 3s 3d 4s D.4f 3p 2p 1s
 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
近年来大气问题受到人们越来越多的关注.按要求回答下列问题:
Ⅰ.实现反应CH4(g)+CO2(g)⇌2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义.在2L密闭容器中,通入5mol CH4与5mol CO2的混合气体,一定条件下发生上述反应,测得CH4的平衡转化率与温度、压强的关系如图1.
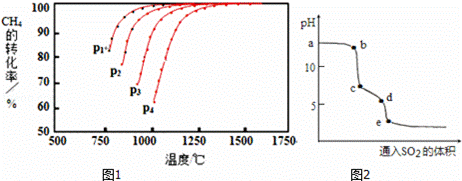
则p1、p2、p3、p4由大到小的顺序 P4>P3>P2>P1 ,该反应的正反应是 吸热 (填“吸热”或“放热”)反应,当1000℃甲烷的转化率为80%时,该反应的平衡常数K= 1024 .
Ⅱ.PM2.5污染与直接排放化石燃烧产生的烟气有关,化石燃料燃烧同时放出大量的SO2和NOx.
(1)处理NOx的一种方法是利用甲烷催化还原NOx.
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=﹣574kJ•mol﹣1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=﹣1160kJ•mol﹣1
CH4(g)+2NO2 (g)=N2(g)+CO2(g)+2H2O(g)△H3
则△H3= ﹣867kJ•mol﹣1 ,如果三个反应的平衡常数依次为K1、K2、K3,则K3= 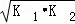 (用K1、K2表示)
(用K1、K2表示)
(2)实验室可用NaOH溶液吸收SO2,某小组同学在室温下,用pH传感器测定向20mL0.1mol•L﹣1NaOH溶液通入SO2过程中的pH变化曲线如图2所示.
①ab段发生反应的离子方程式为 SO2+2OH﹣=SO32﹣+H2O .
②已知d点时溶液中溶质为NaHSO3,此时溶液中离子浓度由大到小的顺序为 c(Na+)>c(HSO3﹣)>c(H+)>c(SO32﹣)>c(OH﹣) ,如果NaHSO3的水解平衡常数Kh=1×10﹣12mol•L﹣1,则该温度下H2SO3的第一步电离平衡常数Ka= 10﹣2mol•L﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A为造纸的原料之一,是一种天然的高分子化合物,D为一种具有水果香味的液体。它们之间的转化关系如下图。
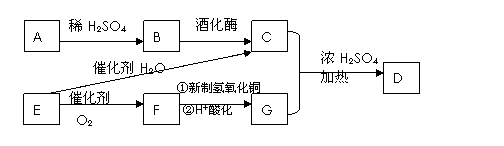

(1)请写出D的结构简式 ,B的官能团名称为 。
(2)写出下列反应的化学方程式,并指明反应类型。
E→C: 反应类型
F→G(与新制氢氧化铜的反应): 反应类型
(3)E常用于制备一种高分子材料,这种高分子化合物的结构简式为
查看答案和解析>>
科目:高中化学 来源: 题型:
已知H2O2分子的结构如图所示,此分子不是直线形的,两个H原子犹如在半展开的书的两面纸上,试推测H2O2可能具有的性质是( )
A.H2O2分子为非极性分子
B.H2O2易溶于CS2
C.H2O2分子中只含σ键
D.H2O2分子中只含极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W为中学化学常见的物质,它们之间的转化关系如图所示:
请填写下列空白。
Ⅰ.若X是酸式盐,Z是NH3.且常温下0.1mol/LX溶液pH≈1
(1)X→Y的离子方程式是 。
(2)X溶液中各种离子浓度由大到小的顺序为 。
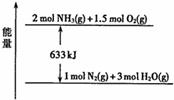
(3)820℃时,一定量NH3和O2反应生成NO和H2O。若该反应
消耗0.20mol NH3,放出热量45.3kJ,结合如图所示能量关系,
写出N2与O2反应生成NO的热化学方程式: 。
Ⅱ.若X是酸,W是一种常见的金属单质
(4)Y→Z的离子方程式是 。
(5)工业上冶炼金属W的原理 。(用化学方程式表示)
(6)食品包装中常见的脱氧剂组成为W粉末、NaCl、炭粉等,其脱氧过程实质上发生了电化学腐蚀,则负极的电极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com