
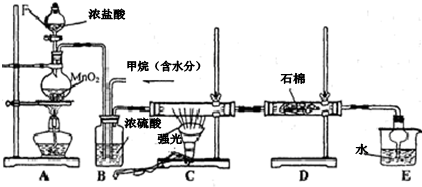
分析 实验室用浓盐酸和二氧化锰在加热条件下发生反应生成Cl2,Cl2经干燥后和甲烷在光照条件下发生取代反应,生成多种氯代烃和HCl,在强光照射下可发生CH4+2Cl2 $\stackrel{光照}{→}$C+4HCl,生成的黑色小颗粒为炭黑,最后生成的HCl溶于水生成盐酸,与有机物可用分液的方法分离.
(1)装置A中二氧化锰与浓盐酸反应生成氯气;
(2)浓硫酸可以干燥氯气和氯化氢;
(3)甲烷可以和氯气发生取代反应,产物为氯化氢和二氯甲烷、三氯甲烷和四氯化碳;
(4)装置中最后剩余的氯化氢气体需要吸收不能排放到空气中,氯化氢易溶于水需要防止倒吸;
(5)甲烷与氯气反应生成氯化氢和碳单质;
(6)最后生成的HCl溶于水生成盐酸,与有机物可用分液的方法分离;一氯甲烷是气体,还可能有过量的甲烷.
解答 解:(1)装置A中二氧化锰与浓盐酸反应生成氯气,其反应的方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)生成的氯气中含有水,B装置除具有控制气流速度、均匀混合气体之外,因浓硫酸具有吸水性,还具有干燥作用,
故答案为:使气体混合均匀,干燥气体;
(3)氯气与甲烷发生取代反应,反应特点是1mol氯气可取代1molH原子生成1molHCl,设$\frac{V(C{l}_{2})}{V(C{H}_{4})}$=x,
若理论上欲获得最多的氯化氢,则x值应保证甲烷被完全取代,x应大于或等于4,
故答案为:≥4;
(4)装置中最后剩余的氯化氢气体需要吸收不能排放到空气中,氯化氢易溶于水需要防止倒吸;
故答案为:CD.
(5)甲烷与氯气反应生成氯化氢和碳单质,其反应的方程式为:CH4+2Cl2$\stackrel{光照}{→}$C+4HCl;
故答案为:CH4+2Cl2$\stackrel{光照}{→}$C+4HCl;
(6)E装置中除了有盐酸生成外,还含有二氯甲烷、三氯甲烷和四氯化碳,二氯甲烷、三氯甲烷和四氯化碳不溶于水,能分层,可用分液分开;反应生成的二氯甲烷、三氯甲烷、四氯化碳均是油状的液体,只有一氯甲烷是气体,还可能有过量的甲烷,可能存在剩余的甲烷和生成的一氯甲烷等气体,应进行尾气处理,
故答案为:分液;A、B.
点评 本题考查氯气的制备以及甲烷与氯气的取代反应,题目难度中等,本题注意把握题给信息,易错点为(6),注意把握产物的判断.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | Na2S溶液使酚酞试液变红:S2-+2H2O?2OH-+H2S | |
| B. | 用右图装置电解CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+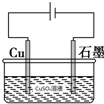 | |
| C. | NaHCO3溶液使酚酞试液变红:HCO3-+H2O?H3O++CO32- | |
| D. | 用AlCl3溶液使石蕊试液变红:Al3++3H2O?Al(OH)3+3 H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
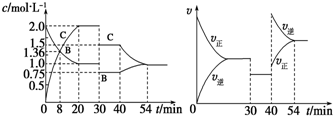
| A. | 8 min时表示正反应速率等于逆反应速率 | |
| B. | 前20 min A的反应速率为0.05 mol•L-1•min-1 | |
| C. | 反应方程式中的x=1,30 min时表示增大压强 | |
| D. | 40 min时改变的条件是升高温度,且正反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,有一种有机物X的键线式如图所示.
,有一种有机物X的键线式如图所示.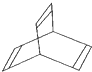
 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HClO4>HBrO4>HIO4 | B. | 碱性:Ba(OH)2>Mg(OH)2>Be(OH)2 | ||
| C. | 非金属性:F>C>O | D. | 气态氢化物稳定性:HF>HCl>H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有如下两个反应:
现有如下两个反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2与O3互为同位素 | |
| B. | O2与O3的相互转化是物理变化 | |
| C. | 在相同的温度与压强下,等体积的O2与O3含有相同的分子数 | |
| D. | 等物质的量的O2与O3含有相同的质子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4v(NH3)=5(O2) | B. | 4 v(NH3)=6 v(H2O) | C. | 4v(O2)=5 v(NO) | D. | 4 v(NH3)=5 v(NO) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com