
| A. | 足量的钠在等物质的量的Cl2和O2中分别燃烧转移电子数 | |
| B. | 等物质的量的KO2与CaO2分别与水反应生成O2的体积(相同条件下) | |
| C. | 100mL 1mol/L HNO3分别与1.4g Fe、2.8gFe完全反应时生成 的NO物质的量 | |
| D. | 等浓度等体积的盐酸、NaOH溶液分别与一定量Al反应生成等质量气体时转移的电子数 |
分析 A.Na与氯气生成NaCl,Na与氧气生成过氧化钠;
B.根据反应方程式4KO2+2H2O=2KOH+3O2↑,2CaO2+2H2O=2Ca(OH)2+O2↑分析判断;
C.根据反应Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O计算;
D.反应生成的氢气相同,则H元素得到的电子相同.
解答 解:A.足量的钠在等物质的量的Cl2和O2中分别燃烧转移电子数,Na与氯气生成NaCl,Na与氧气生成过氧化钠,1molCl2和O2都转移2mol电子,即转移电子数相同,故A不选;
B.KO2与CaO2分别与水反应生成氧气,两个反应的方程式分别为:4KO2+2H2O=2KOH+3O2↑,2CaO2+2H2O=2Ca(OH)2+O2↑,所以等物质的量的KO2与CaO2分别与水反应生成的气体体积不同,故B选;
C.100mL 1mol/L HNO3与1.4g Fe反应发生的方程式为Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,二者恰好反应生成0.025molNO,3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,100mL 1mol/L HNO3分别与2.8gFe反应,硝酸的物质的量为0.1mol,Fe为0.5mol,发生3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,硝酸不足,按照硝酸计算得到NO为0.025mol,所以两个反应生成的NO相同,故C不选;
D.等浓度等体积的盐酸、NaOH溶液分别与一定量Al反应生成等质量的氢气,生成1mol氢气转移2mol电子,由于生成的氢气相同,所以转移的电子数相同,故D不选.
故选B.
点评 本题考查了钠的性质、氧化还原反应、物质的量的相关计算,侧重于学生的分析能力和计算能力的考查,注意把握物质存在的状态、构成以及物质的量的相关计算公式,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
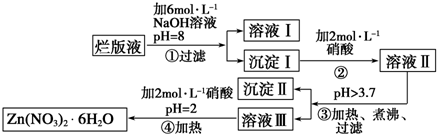
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
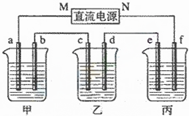 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.85%的NaCl溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.85%的NaCl溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
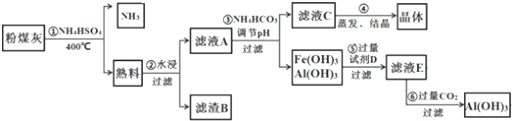
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
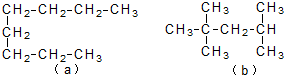
| A. | a和b都不能使酸性KMnO4溶液褪色 | |
| B. | a和b分子中的所有碳碳单键间的键角都相同 | |
| C. | a的沸点比b高 | |
| D. | b脱氢可以形成3种单烯烃分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com