
分析 (1)正反应为吸热反应,升高温度平衡正向移动;混合气体总质量不变,容器容积不变;
(2)正反应为吸热反应,降低温度平衡逆向移动,混合气体总物质的量增大,而混合气体总质量不变;
(3)加入催化剂,平衡不移动;充入C,平衡逆向移动.
解答 解:(1)正反应为吸热反应,升高温度平衡正向移动,B的浓度减小、C的浓度增大,则$\frac{c(B)}{c(C)}$的比值减小;
混合气体总质量不变,容器容积不变,混合气体密度不变,
故答案为:减小;不变;
(2)正反应为吸热反应,降低温度平衡逆向移动,混合气体总物质的量增大,而混合气体总质量不变,平均相对分子质量减小,
故答案为:减小;
(3)加入催化剂,平衡不移动,气体的总物质的量不变;充入C,平衡逆向移动,A、B物质的量增大,
故答案为:不变;增大.
点评 本题考查化学平衡计算及影响因素,比较基础,注意对平衡移动原理的理解掌握.


 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:解答题
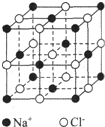
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na:两个钠元素 | |
| B. | 2OH-:两个氢氧根离子 | |
| C. | $\stackrel{+2}{M}$g:镁元素的化合价为+2价 | |
| D. | NO2:一个二氧化氮分子含有两个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
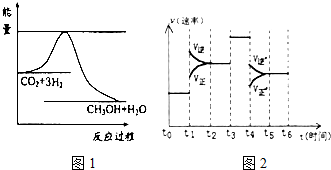 煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 0.4 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量NaHCO3、Na2CO3分别与同浓度盐酸完全反应,消耗的盐酸体积Na2CO3是NaHCO3的二倍 | |
| B. | Na2O2和Na2O均可以和盐酸反应生成相应的盐,都属于碱性氧化物 | |
| C. | 将澄清石灰水分别加入NaHCO3和Na2CO3两种盐溶液中,只有Na2CO3溶液产生沉淀 | |
| D. | Na2O2和Na2O中Na2O更稳当,Na2O2在一定条件下可以转化为Na2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
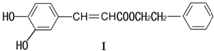
| A. | 遇FeCl3溶液可能显紫色 | |
| B. | 可发生酯化反应和银镜反应 | |
| C. | 能与溴发生取代和加成反应 | |
| D. | 1mol化合物I最多能与2molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 | 药品 | 制取气体 | 量气管中的液体 |
| Ⅰ | Cu、稀HNO3 | H2O | |
| Ⅱ | NaOH固体、浓氨水 | NH3 | |
| Ⅲ | 镁铝合金、足量NaOH溶液 | H2 | H2O |
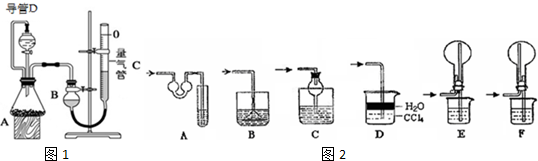
| 编号 | 镁铝合金质量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 1.0g | 10.0mL | 376.6mL |
| ② | 1.0g | 10.0mL | 364.7mL |
| ③ | 1.0g | 10.0mL | 377.0mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  干燥Cl2 | |
| B. |  配制90ml 0.1mol•L-1硫酸溶液 | |
| C. |  分离沸点相差较大的互溶液体混合物 | |
| D. |  分离互不相溶的两种液体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com