
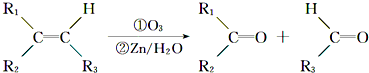
| 2×9+2-10 |
| 2 |
 ,由A→B→C,C能发生银镜反应,则C属醛类,故A中双键碳上有氢原子,E与A含有官能团相同,由E→F→G,G能发生银镜反应,G酸化得到H,则H中含有-CHO、酚羟基,由H的分子式可知,H为
,由A→B→C,C能发生银镜反应,则C属醛类,故A中双键碳上有氢原子,E与A含有官能团相同,由E→F→G,G能发生银镜反应,G酸化得到H,则H中含有-CHO、酚羟基,由H的分子式可知,H为 (可以为邻位、对位),由于臭氧氧化过程会发生碳链的断裂,可推知E比A少1个碳原子,比H多1个碳原子,故E为
(可以为邻位、对位),由于臭氧氧化过程会发生碳链的断裂,可推知E比A少1个碳原子,比H多1个碳原子,故E为 ,F为
,F为 ,则A为
,则A为 ,B为
,B为 ,C为
,C为 ,D为
,D为 .
.| 2×9+2-10 |
| 2 |
 ,由A→B→C,C能发生银镜反应,则C属醛类,故A中双键碳上有氢原子,E与A含有官能团相同,由E→F→G,G能发生银镜反应,G酸化得到H,则H中含有-CHO、酚羟基,由H的分子式可知,H为
,由A→B→C,C能发生银镜反应,则C属醛类,故A中双键碳上有氢原子,E与A含有官能团相同,由E→F→G,G能发生银镜反应,G酸化得到H,则H中含有-CHO、酚羟基,由H的分子式可知,H为 (可以为邻位、对位),由于臭氧氧化过程会发生碳链的断裂,可推知E比A少1个碳原子,比H多1个碳原子,故E为
(可以为邻位、对位),由于臭氧氧化过程会发生碳链的断裂,可推知E比A少1个碳原子,比H多1个碳原子,故E为 ,F为
,F为 ,则A为
,则A为 ,B为
,B为 ,C为
,C为 ,D为
,D为 ,
, ;
; ;
; .注意(苯环上的2个基团在邻、间、对位均合理).
.注意(苯环上的2个基团在邻、间、对位均合理).


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:

| Fe |
| 气体丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
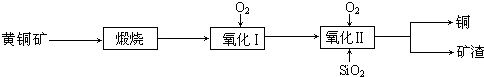
| 沸腾炉温度/℃ | 560 | 580 | 600 | 620 | 640 | 660 |
| 水溶性Cu/% | 90.12 | 91.24 | 93.50 | 92.38 | 89.96 | 84.23 |
| 酸溶性Cu/% | 92.00 | 93.60 | 97.08 | 97.82 | 98.16 | 98.19 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶解 |
| ① |
| BaCl2 |
| ② |
| 试剂A |
| ③ |
| Na2CO3 |
| ④ |
| 过滤 |
| ⑤ |
| 适量盐酸 |
| ⑥ |
| 蒸发、结晶、烘干 |
| ⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
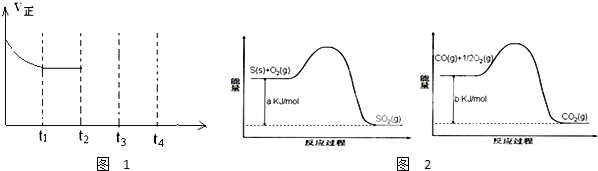
| 180℃ |
| 催化剂 |
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入AgNO3溶液有白色沉淀生成,证明原溶液中一定有大量Cl- |
| B、加入硝酸后的溶液中,滴加BaCl2溶液,有白色沉淀生成,证明原溶液中一定有大量SO42- |
| C、加入盐酸后,放出能使澄清石灰水变浑浊的无色气体,证明原溶液中一定含有大量CO32- |
| D、加入无色酚酞试液后,溶液显红色,证明原溶液中一定含有大量OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
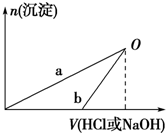 某同学研究铝及其化合物的性质时设计了如下两个实验方案.
某同学研究铝及其化合物的性质时设计了如下两个实验方案.| 100mL稀盐酸 |
| NaOH溶液 |
| 100mLNaOH溶液 |
| 稀盐酸 |
| A、在O点时两方案中所得溶液的溶质物质的量相等 |
| B、b曲线表示的是向X溶液中加入NaOH溶液 |
| C、X溶液溶质为AlCl3,Y溶液溶质为NaAlO2 |
| D、a、b曲线表示的反应都是氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com