
| A. | ①②④⑤⑦ | B. | ①③⑤④ | C. | ①②③⑤⑥ | D. | ③④⑤⑦ |
分析 ①由同一种元素组成的纯净物是单质;
②阴离子可能金属元素,阳离子不一定含金属元素;
③大多数金属氧化物是碱性氧化物;
④碱性氧化物一定是金属氧化物;
⑤非金属氧化物不一定是酸性氧化物;
⑥酸性氧化物不一定是非金属氧化物;
⑦酸的元数和酸电离出的氢离子数目有关.
解答 解:①由同一种元素组成的纯净物是单质,由同一种元素组成的物质不一定是单质,如氧气和臭氧组成的混合物,虽然是只有一种元素组成,故错误;
②阴离子可能金属元素,如高锰酸根离子,阳离子不一定含金属元素,如铵根离子,故错误;
③大多数金属氧化物是碱性氧化物,氧化铝属于两性氧化物,不是碱性氧化物,故错误;
④碱性氧化物一定是金属氧化物,故正确;
⑤非金属氧化物不一定是酸性氧化物,如NO、CO属于不成盐氧化物,故错误;
⑥酸性氧化物不一定是非金属氧化物,如七氧化二锰,故错误;
⑦酸的元数和酸电离出的氢离子数目有关,不一定等于酸中的H原子数,故正确.
故选C.
点评 本题考查学生物质的分类知识,注意概念的理解和应用是关键,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①④ | C. | ①②③④ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤⑥⑦ | B. | ②③④⑧⑨⑩ | C. | ①②⑤⑥⑦ | D. | ①⑤⑥⑦⑨⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
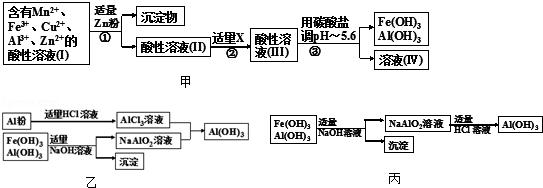
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 实验①中产生的气体为氨气,并可得原溶液中c(NH4+)=0.2 mol•L-1 | |
| B. | 实验③中的白色沉淀中一定有BaSO4,无BaCO3 | |
| C. | 原溶液中一定有K+,且c(K+)=0.4 mol•L-1 | |
| D. | 若要判断原溶液中是否有Cl-,无需另外设计实验验证 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
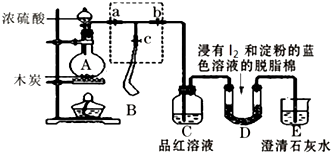
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com