
����˵����ȷ����
A����֪ ����Լ���CH3��CH3 �� CH2��CH2��H2����H =��125.6 kJ/mol
����Լ���CH3��CH3 �� CH2��CH2��H2����H =��125.6 kJ/mol
B����˵��NH3���H+������H2Oǿ��NH3+H3O+=NH+4+H2O
C����֪�����Ȼ�ѧ����ʽ��2H2(g)+O2(g) === 2H2O(g) ��H����484kJ/mol����������ȼ����Ϊ��242kJ/mol
D����֪�к���Ϊ��57.4kJ/mol ����NaOH��aq�� ��CH3COOH��aq����CH3COONa��aq����H2O��l������H ����57.4kJ/mol
B
��������
���������A�����ݷ�Ӧ�ȵ��ڷ�Ӧ��ļ���֮�ͼ�ȥ������ļ���֮�ͣ���CH3-CH3��CH2=CH2+H2�ġ�H=+728.3 kJ/mol������B���ɷ�ӦNH3+H3O+=NH4++H2O֪���������ܶ�ȡˮ���������е������ӣ�˵��NH3���H+������H2Oǿ����ȷ��C��ȼ������ָ1mol��ȼ����ȫȼ�������ȶ���������ʱ�ų���������ˮ��״̬ӦΪҺ̬ˮ������D���к��ȣ�57.4kJ/mol����������Ϊ��ϡ��Һ��ǿ����ǿ�Ӧ������1molˮ����NaOH��aq����CH3COOH��aq����CH3COONa��aq����H2O��l����Ӧ�����ж�һ�������������ȹ��̣���H ����57.4kJ/mol������
���㣺���鷴Ӧ�ȵļ��㣬ȼ���ȡ��к��ȵĸ��


 ���źþ���Ԫ����ĩ��ϵ�д�
���źþ���Ԫ����ĩ��ϵ�д� һ����ʦȨ����ҵ��ϵ�д�
һ����ʦȨ����ҵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015�ӱ�ʡ�߶���ѧ�ڵ������¿���ѧ�Ծ��������棩 ���ͣ������
��12�֣���ͼ��һ����ѧ���̵�ʾ��ͼ��
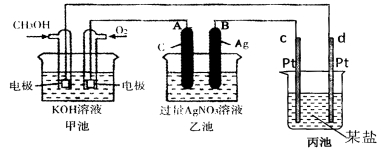
��1��ͼ���ҳ��� װ�á�
��2��c��Pt���缫�������� ��
��3��д��ͨ��CH3OH�缫�ĵ缫��Ӧʽ�� ��
��4���ҳ��з�Ӧ�����ӷ���ʽΪ ��
��5�����ҳ���B��Ag��������������5��40gʱ���׳�������������O2 mL����״���£�����ʱ����ij�缫����1.6gij����������е�ij����Һ������ ������ţ�
A��MgSO4 B��CuSO4 C��NaCL D��AgNO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�긣��ʡ������ѧ�ڵ��Ĵ��¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪A��B��C��D��E�Ƕ�������ԭ���������������5������Ԫ�أ�����Ԫ��A��E�ĵ����ڳ����³���̬��Ԫ��B��ԭ������������������Ӳ�����2����Ԫ��C��ͬ���ڵ�����Ԫ���� ԭ�Ӱ뾶���Ԫ��D��
ԭ�Ӱ뾶���Ԫ��D�� �Ͻ����ճ������г��õĽ������ϡ�����˵����ȷ����
�Ͻ����ճ������г��õĽ������ϡ�����˵����ȷ����
A��Ԫ��A��B��ɵĻ����ﳣ����һ������̬
B��Ԫ ��C��D������������Ӧ��ˮ����֮�䲻�ܷ�����Ӧ
��C��D������������Ӧ��ˮ����֮�䲻�ܷ�����Ӧ
C����ҵ�ϳ��õ�ⷨ�Ʊ�Ԫ��C��D��E�ĵ���
D��������AE��CE������ͬ���͵Ļ�ѧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����������и�����ѧ�ڵ������¿������Ծ��������棩 ���ͣ�ѡ����
�������ӷ���ʽ��д��ȷ����
A��̼�������Һ��������������Һ��ϣ�Ca2++2HCO3����OH����CaCO3��+CO32����H2O
B��CuCl2��Һ��Na2S��Һ2:1��Ӧ��Cu2++ S2��= CuS��
C����Ũ�����ữ��KMnO4��Һ��H2O2��Ӧ��֤��H2O2���л�ԭ�ԣ�2MnO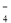 + 6H+ + 5H2O2 �� 2Mn2+ + 5O2�� + 8H2O
+ 6H+ + 5H2O2 �� 2Mn2+ + 5O2�� + 8H2O
D����������Һ�еμ�Ba(OH)2��Һ��ǡ��ʹSO42-������ȫ��2Al3++3SO42-+3Ba2++6OH -=2 Al(OH)3��+3BaSO4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���㽭ʡ������ѧ��10���¿���ѧ�Ծ��������棩 ���ͣ������
��12�֣�A��B��C��DΪԭ������������������ֶ�����Ԫ�أ������ʻ�ṹ��Ϣ���±���
Ԫ�� | A | B | C | D | E |
���� ��� ���� Ϣ | �����µ��ʳ���̬��ԭ��������������D��ͬ | D3B���������������ӵĵ��Ӳ�ṹ��ͬ | A��C���γ����ֳ����Ļ�������ң��Ҿ��������� | ��������������ɫ���塢������ǿ���ڿ�����ȼ�����ɵ���ɫ���� | E����̬�⻯�������������Ӧ��ˮ�����Ϊǿ�ᣬC��D��E����Ԫ���γɵ�һ���α�Ϊij����Һ����Ҫ�ɷ� |
�Իش���������
��1��B�����ڱ��е�λ���� ��B���⻯����E���⻯��Ƚϣ��е�ϸߵ��� ���ѧʽ����
��2��D3B����ˮ��Ӧ����2�ּ������ʣ���д����һ��ѧ����ʽ ��
��3��д�����ĵ���ʽΪ ����˵�����ڿ�����Ư��ԭ�����û�ѧ����ʽ��ʾ�� ������ο��±����ݣ�
�� | ���볣�� |
HClO | Ka=3.0��10-8 |
H2CO3 | Ka1=4.3��10-7��Ka2=5.6��10-11 |
��4����A��B��C��D����Ԫ���е�����Ԫ����ɵ�һ���ζ�����������Ȼ������ƣ�����ˮ��Һ�ʼ��ԡ���������ͭ˿���붡��Һ�У�û�������������������ữ����ӦѸ�ٷ�����ͭ˿�����ܽ���������ɫ��Һ��д���÷�Ӧ�����ӷ���ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���㽭ʡ������ѧ��10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
���и���������ָ����Һ��һ���ܴ����������
A��pH��13����Һ�У�AlO2����CO32-��NO3-��Na��
B�����ȳʻ�ɫ����Һ�У�I����Cl����NO3-��Na��
C��������Al3������Һ�У�K����NH4+��NO3-��HCO3-
D������ˮ�������c(OH��)��10��13 mol��L��1����Һ�У�Ba2����CO32-��ClO����Na��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���㽭ʡ������ѧ��10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ܱ������зֱ����Ne��H2��O2�������壬�����ǵ��¶Ⱥ��ܶȶ���ͬʱ�������������ѹǿ��p����С�������
A��p (Ne) < p (H2) < p (O2) B��p (H2) < p (O2) < p (Ne)
C��p (O2) < p (Ne) < p (H2) D��p (H2) < p (Ne) < p (O2)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���Ĵ�ʡ�����и���һ��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��NAΪ�����ӵ�������ֵ������������ȷ����
A��1.7 g�ǻ��������ӵ���ĿΪNA
B��0.1 mol��ϩȩ�к���˫������ĿΪ0.1NA��
C������ʱ��pH=13��1.0L Ba(OH)2��Һ�к���OH-����ĿΪ0.2NA
D����״���£�7.8 g���к���ԭ�ӵ���ĿΪ0.6NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡӢ��ѧУ������ѧ��12���¿���ѧ�Ծ��������棩 ���ͣ������
(12��)����ұ���ʹ������漰���෴Ӧ��
��1������������ұ����Ӧ����ʱ���õ�ⷨ����______
a��Fe2O3 b��NaCl c��Cu2S d��Al2O3
��2����ͭ��Cu2S���ɷ�����Ӧ2Cu2S + 2H2SO4 + 5O2 �� 4CuSO4 + 2H2O���÷�Ӧ�Ļ�ԭ����______����1molO2������Ӧʱ����ԭ����ʧ���ӵ����ʵ���Ϊ______mol��
��3��ͼΪ��⾫������ʾ��ͼ��______����a��b����Ϊ�������ʵĴ�������b������������ɫ�������ɣ������ɸ�����ĵ缫��ӦʽΪ ��
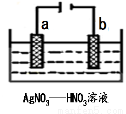
��4��Ϊ������������ĺڰߣ�Ag2S�������������������������ʳ��ˮ�в������Ӵ���Ag2Sת��ΪAg��ʳ��ˮ������Ϊ �����ܷ�ӦʽΪ�� ��
��5����¯������ұ��������Ҫ��������������Ҫ��ӦΪ��Fe2O3��s��+3CO��g��= 2Fe��s��+3CO2��g��
��֪����FeO(s) + CO(g) �� Fe(s) + CO2(g) ��H1����11KJ/mol
��3Fe2O3(s) + CO(g) �� 2Fe3O4(s) + CO2(g) ��H2����47KJ/mol
��Fe3O4(s) + CO(g) �� 3FeO(s) + CO2(g) ��H3��+19KJ/mol
��ӦFe2O3��s�� + 3CO��g��= 2Fe��s��+ 3CO2��g���ġ�H�� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com