
| A.由于红磷转化为白磷是放热反应,等质量的红磷能量比白磷低 |
| B.稀硫酸与稀NaOH溶液反应的中和热△H=57.3 kJ/mol |
| C.碳的燃烧热大于-110.5 kJ/mol |
| D.稀醋酸与稀NaOH溶液反应生成1 mol水,△H 大于 -57.3 kJ/mol |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题
| A.已知2H2(g)+O2(g)=2H2O(l) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为483.6 kJ·mol-1 |
| B.已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定 |
| C.已知2C(s)+2O2(g)=2CO2(g) ΔH1 2C(s)+O2(g)=2CO(g) ΔH2 则ΔH1>ΔH2 |
| D.已知Ni(CO)4(s)=Ni(s)+4CO(g) ΔH=+Q kJ·mol-1,则Ni(s)+4CO(g)=Ni(CO)4(s) ΔH=-Q kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 O2(g)=
O2(g)= P4O10(s) △H=-738.5kJ·mol-1
P4O10(s) △H=-738.5kJ·mol-1 查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
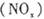 、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等。
、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等。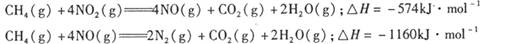
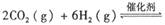
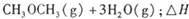 。已知在一定压强下,该反应随温度的升高而CO2的转化率降低。则该反应的
。已知在一定压强下,该反应随温度的升高而CO2的转化率降低。则该反应的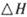 ________ 0(填“ >”或“ <”);若用以甲醚、空气、氢氧化钾溶液为原料,石墨为电极构成燃料电池,则该电池中负极的电极反应式是________________________________,放电过程中溶液的PH________ (填“增大”、“减小”或“不变”)。
________ 0(填“ >”或“ <”);若用以甲醚、空气、氢氧化钾溶液为原料,石墨为电极构成燃料电池,则该电池中负极的电极反应式是________________________________,放电过程中溶液的PH________ (填“增大”、“减小”或“不变”)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.△H=-1141.8 kJ·mol-1 | B.△H=+260.4kJ·mol-1 |
| C.△H=+441.8 kJ·mol-1 | D.△H=-260.4 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
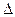 H1=" +1175.7" kJ·mol-1
H1=" +1175.7" kJ·mol-1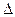 H2=" +771.1" kJ·mol-1
H2=" +771.1" kJ·mol-1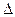 H3=" -482.2" kJ·mol-1
H3=" -482.2" kJ·mol-1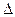 H是
H是| A.77.6 kJ | B.-77.6 kJ·mol-1 | C.+77.6kJ·mol-1 | D.-886.8kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
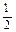 O2(g) =" CO" (g)
O2(g) =" CO" (g) 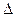 H1= —110.5kJ/mol
H1= —110.5kJ/mol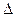 H2= —393.5kJ/mol
H2= —393.5kJ/mol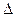 H为
H为| A.+ 283.5kJ/mol | B.+ 172.5kJ/mol |
| C.—172.5kJ/mol | D.—504kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.-824.4kJ·mol- 1 | B.-627.6kJ·mol-1 |
| C.-744.7kJ·mol-1 | D.-169.4kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2O(l)====H2O(g);△H=+44kJ·mol-1,则16 g液态肼燃烧生成氮气和液态水时,放出的热量是________kJ。
2O(l)====H2O(g);△H=+44kJ·mol-1,则16 g液态肼燃烧生成氮气和液态水时,放出的热量是________kJ。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com