
| A. | 氯水的颜色呈浅绿色,说明氯水中含有Cl2 | |
| B. | 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- | |
| C. | 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有 H+ | |
| D. | 新制的氯水能使红色布条褪色,说明氯水中含有Cl2 |
分析 溶液中存在平衡Cl2+H2O?HCl+HClO,只有氯气有颜色,为黄绿色,氯水中含有氯气而呈浅黄绿色,溶液中HCl与硝酸银反应产生AgCl白色沉淀,而溶液呈酸性,能与碳酸氢钠反应生成二氧化碳,溶液中氯气、HClO都强氧化性,都可以将亚铁离子氧化为铁离子,而使溶液变为棕黄色,以此解答该题.
解答 解:溶液中存在平衡Cl2+H2O?HCl+HClO,
A.只有氯气有颜色,为黄绿色,氯水呈浅黄绿色是由于含有氯气,故A正确;
B.溶液与硝酸银反应产生白色沉淀,只能是氯离子与银离子反应得到AgCl白色沉淀,说明氯水中含有Cl-,故B正确;
C.溶液呈酸性,能与碳酸氢钠反应生成二氧化碳,故C正确;
D.新制的氯水能使红色布条褪色,说明氯水中含有HClO,故D错误.
故选D.
点评 本题综合考查氯气及氯水的性质,为高频考点,侧重于元素化合物知识的综合理解和运用的考查,难度不大,注意相关基础知识的积累,难度不大.


科目:高中化学 来源: 题型:填空题
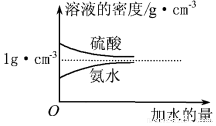
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
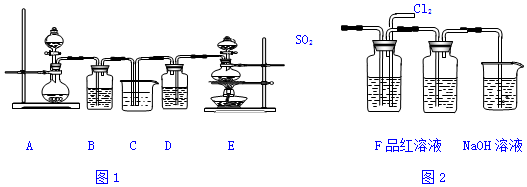
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Z>M>N>X>Y | B. | M与N形成的化合物中N显正价 | ||
| C. | 单质沸点:Z>M>N>Y>X | D. | 最高正价:N>M=Y>Z=X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠溶液与稀盐酸反应:H++OH-=H2O | |
| B. | 铁和稀盐酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 碳酸钠溶液与稀盐酸反应:Na2CO3+2H+=2Na++H2O+CO2↑ | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-=BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | RCl | B. | RCl2 | C. | RCl3 | D. | RCl4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氯及其化合物在生产、生活中有广泛的用途.回答下列问题:
氯及其化合物在生产、生活中有广泛的用途.回答下列问题:| 容器编号 | 温度/℃ | 容器体积/L | Cl02(g)的平衡转化率 |
| a | T1 | V1=l L | 75% |
| b | T1 | v2 | |
| c | T3 | v3 | 75% |
| d | |||
| e |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com