
【题目】(1)配制 500 mL 浓度为 0.2 mol·L-1 稀硫酸,需用量筒量取密度为 1.84 g·cm-3 溶质质量分数为98%的浓 H2SO4 __________mL,然后再与适量水混合稀释,待________ 后,再转移 到____中,定容,摇匀。
(2)在实验(1)中,其他操作均正确,但定容时俯视刻度线,会导致所配制的溶液中溶质的物质的量浓度_________ (填“大于”“小于”或“等于”)0.2 mol·L-1。
(3)在实验(1)中,转移溶液至容量瓶中时洒落少许,则所配制的溶液中溶质的物质的量浓度 (填 “大于”“小于”或“等于”)______________0.2 mol·L-1。
【答案】5.4 冷却至室温 500 mL 容量瓶 大于 小于
【解析】
(1)由浓硫酸配制稀硫酸,硫酸溶质的物质的量不变,根据稀释原理,可得,c稀V稀=c浓V浓,c浓硫酸=![]() =
=![]() =18.4mol/L,则V浓=
=18.4mol/L,则V浓=![]() ,浓硫酸稀释过程中会放出大量的热,在转移至容量瓶前需要冷却至室温,再转移至500ml容量瓶中;
,浓硫酸稀释过程中会放出大量的热,在转移至容量瓶前需要冷却至室温,再转移至500ml容量瓶中;
(2) 在实验(1)中,其他操作均正确,但定容时俯视刻度线,容量瓶中溶液的体积偏小,
会导致所配制的溶液中溶质的物质的量浓度偏高;
实验(1)中,转移溶液至容量瓶中时洒落少许,导致溶质的物质的量减少,则所配制的溶液中溶质的物质的量浓度偏小。
(1)由浓硫酸配制稀硫酸,硫酸溶质的物质的量不变,根据稀释原理,可得,c稀V稀=c浓V浓,c浓硫酸=![]() =
=![]() =18.4mol/L,则V浓=
=18.4mol/L,则V浓=![]() ,浓硫酸稀释过程中会放出大量的热,在转移至容量瓶前需要冷却至室温,再转移至500mL容量瓶中,
,浓硫酸稀释过程中会放出大量的热,在转移至容量瓶前需要冷却至室温,再转移至500mL容量瓶中,
故答案为:5.4;冷却至室温;500 mL 容量瓶;
(2) 在实验(1)中,其他操作均正确,但定容时俯视刻度线,容量瓶中溶液的体积偏小,会导致所配制的溶液中溶质的物质的量浓度大于0.2 mol·L-1,
故答案为:大于;
(3)在实验(1)中,转移溶液至容量瓶中时洒落少许,导致溶质的物质的量减少,则所配制的溶液中溶质的物质的量浓度小于0.2 mol·L-1,
故答案为:小于。


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是
A.铝粉投入到NaOH溶液中:2Al+2OH-=2AlO2-+H2↑
B.AlCl3溶液中加入过量的氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
C.三氯化铁溶液中加入金属钠:3Na+Fe3+=3Na++Fe
D.NaAlO2溶液中通入过量的CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X是药物的中间体,它的一种合成路线如下。
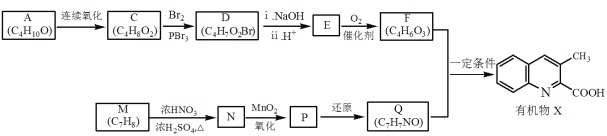
已知:RNH2+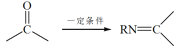 +H2O
+H2O
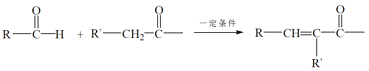
(1)A无支链,A中含有的官能团名称是___。
(2)A连续氧化的步骤如下:
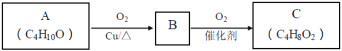
A转化为B的化学方程式是___。
(3)M为芳香化合物,其结构简式是___。
(4)M→N的化学方程式是___,反应类型是___。
(5)下列说法不正确的是___。
a.1molD与NaOH溶液反应时,最多消耗2molNaOH
b.E在一定条件下可生成高分子化合物 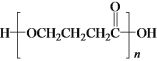
c.F能发生酯化反应和消去反应
(6)Q的结构简式是___。
(7)以乙烯为起始原料,选用必要的无机试剂合成A,写出合成路线___(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在生活中 Na2CO3和NaHCO3都可作食用碱。下列对其性质的描述用化学方程式或离子方程式表示正确的是
A.NaHCO3可作发酵粉:2NaHCO3 ![]() Na2CO3 + CO2↑ + H2O
Na2CO3 + CO2↑ + H2O
B.饱和Na2CO3溶液中通入CO2: CO32- +CO2+ H2O → HCO3-
C.Na2CO3溶液呈碱性:CO32-+ 2H2O → H2CO3+ 2OH-
D.饱和Na2CO3溶液除去CH3COOC2H5中的CH3COOH:CO32- + 2H+ →CO2↑ + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粗盐中常含 Ca2+、Mg2+、SO42-以及泥沙等杂质,一种制备精盐的实验方案及步骤如下(用于沉淀的试剂饱和 Na2CO3 溶液、BaCl2 溶液、NaOH 溶液均稍过量):
![]()
(1)若试剂①选用 NaOH 溶液,则试剂②产生的沉淀的化学式为 ___________。判断滴加试剂③ 已过量的方法是:__________。
(2)操作Ⅱ为___________。溶液丙中,溶质除 NaCl 外还含有____________(填化学式)等。
(3)食用盐常在精盐中加入 KIO3。为了检验实验中是否含 KIO3,可以用以下反应进行:KIO3+5KI+3H2SO4![]() 3I2+3K2SO4+3H2O。
3I2+3K2SO4+3H2O。
①用双线桥分析以上反应中电子转移的方向和数目:_____。
②反应中氧化剂与还原剂的物质的量之比为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明N2O与CO在Fe+作用下发生反应的能量变化及反应历程如图所示,下列说法错误的是
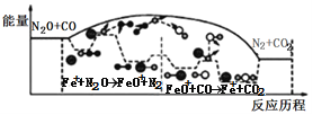
A.反应总过程是放热的
B.Fe+作为催化剂改变了反应途径,提高了反应速率
C.Fe++N2O→FeO++N2、FeO++CO→Fe++CO2 两步反应均为放热反应
D.若反应在恒容密闭容器中进行,温度越高,反应速率一定越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,质量相同的CO2、H2、O2、CH4、SO2五种气体,下列说法错误的是
A.所占的体积由大到小的顺序是:H2>CH4>O2>CO2>SO2
B.所含分子数由多到少的顺序是:H2>CH4>O2>CO2>SO2
C.所含的电子数由多到少的顺序是:SO2>CO2>O2>CH4>H2
D.密度由大到小的顺序是:SO2>CO2>O2>CH4>H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,相同浓度的两种一元酸HX、HY分别用同一浓度的NaOH标准溶液滴定,滴定曲线如图所示。下列说法正确的是![]()
![]()
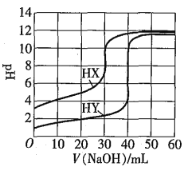
A.HX、HY起始溶液体积相同
B.均可用甲基橙作滴定指示剂
C.pH相同的两种酸溶液中:![]()
D.同浓度KX与HX的混合溶液中,粒子浓度间存在关系式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用下图表示。
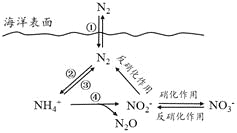
(1)海洋中的氮循环起始于氮的固定,其中属于固氮作用的一步是_______(填图中数字序号)。
(2)下列关于海洋氮循环的说法正确的是__________(填字母序号)。
a.海洋中存在游离态的氮
b.海洋中的氮循环起始于氮的氧化
c.海洋中的反硝化作用一定有氧气的参与
d.向海洋排放含NO3-的废水会影响海洋中NH4+的含量
(3)有氧时,在硝化细菌作用下,NH4+可实现过程④的转化,将过程④的离子方程式补充完整:
________NH4++ 5O2=2NO2-+ ________H++__________+__________
(4)有人研究了温度对海洋硝化细菌去除氨氮效果的影响,下表为对10 L人工海水样本的监测数据:
温度/℃ | 样本氨氮含量/mg | 处理24 h | 处理48 h |
氨氮含量/mg | 氨氮含量/mg | ||
20 | 1008 | 838 | 788 |
25 | 1008 | 757 | 468 |
30 | 1008 | 798 | 600 |
40 | 1008 | 977 | 910 |
硝化细菌去除氨氮的最佳反应温度是_____________,在最佳反应温度时,48 h内去除氨氮反应的平均速率是____________mg·L-1·h-1。
(5)为了避免含氮废水对海洋氮循环系统的影响,需经处理后排放。右图是间接氧化工业废水中氨氮(NH4+)的示意图。
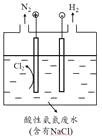
① 结合电极反应式简述间接氧化法去除氨氮的原理:_______________。
② 若生成H2和N2的物质的量之比为3:1,则处理后废水的pH将___________(填“增大”、“不变”或“减小”),请简述理由:_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com