
【题目】向10 mL浓度均为3 mol·L-1的HNO3与H2SO4的混合溶液中加入1.92 g铜,充分反应后,设溶液体积仍为10 mL。求:
(1)产生的气体在标准状况下的体积是多少升_____?
(2)反应后溶液中各溶质的离子浓度是多少 ______? (反应完溶液中溶质的离子有Cu2+、H+、、NO3-、 SO42-)(以上要求写出计算过程)
【答案】0.448 L Cu2+:3 mol·L-1 H+:1 mol·L-1 NO3-:1 mol·L-1 SO42-:3 mol·L-1
【解析】
根据铜与稀硝酸反应的离子反应过程分析解答。
(1)n(Cu)= ![]() =0.03mol,n(H+)=3molL-1×0.01L×1+3molL-1×0.01L×2=0.09mol,n(NO3-)=3molL-1×0.01L=0.03mol,根据离子反应方程式:3Cu+8H++2NO3-=3 Cu2++2NO↑+4H2O 可知,Cu完全反应,H+和NO3-过量,由反应的离子方程式可知:n(NO)=0.03mol×2÷3=0.02mol, V(NO)=0.02mol×22.4L/mol=0.448L;
=0.03mol,n(H+)=3molL-1×0.01L×1+3molL-1×0.01L×2=0.09mol,n(NO3-)=3molL-1×0.01L=0.03mol,根据离子反应方程式:3Cu+8H++2NO3-=3 Cu2++2NO↑+4H2O 可知,Cu完全反应,H+和NO3-过量,由反应的离子方程式可知:n(NO)=0.03mol×2÷3=0.02mol, V(NO)=0.02mol×22.4L/mol=0.448L;
故答案为:0.448 L;
(2) 由离子方程式可知1.92 g Cu为0.03 mol,反应中消耗H+ 0.08 mol,消耗NO3- 0.02 mol,生成Cu2+ 0.03 mol,可得:c(Cu2+)=0.03mol÷0.01L=3 mol·L-1,反应后c(H+)=(0.09mol-0.08mol) ÷0.01L=1 mol·L-1,反应后n(NO3-)=0.03-0.02=0.01mol,故c(NO3-)=0.01mol÷0.01L=1 mol·L-1,因为SO42-没有参加反应,故SO42-的离子浓度仍为3 mol·L-1。
故答案为:Cu2+:3 mol·L-1,H+:1 mol·L-1,NO3-:1 mol·L-1,SO42-:3 mol·L-1。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在容积为2L的恒容密闭容器中发生反应xA(g)+ yB(g)![]() zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系;则下列结论正确的是
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系;则下列结论正确的是
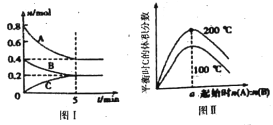
A. 图II所知反应xA(g)+yB(g) ![]() zC(g) △H<0,且a=2
zC(g) △H<0,且a=2
B. 200℃时,该反应的平衡常数为25
C. 200℃时,反应从开始到平衡的平均速率v(B)=0.04mol/(Lmin)
D. 当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH) 2CO3等杂质]为原料制取二氧化锰,其流程示意图如下:
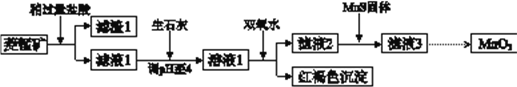
已知:生成氢氧化物沉淀的pH
Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
注:金属离子的起始浓度为0.1 mol/L
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是_________。盐酸溶解MnCO3的化学方程式是_________。
(2)向溶液1中加入双氧水时,反应的离子方程式是___________。
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是__________。
(4)将MnCl2转化为MnO2的一种方法是氧化法。用酸化的NaClO3溶液将MnCl2氧化生成MnO2和Cl2,该反应的离子方程式为___________。
(5)将MnCl2转化为MnO2的另一种方法是电解法。
① 生成MnO2的电极反应式是___________。
② 若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2。检验Cl2的操作是_________。
③ 若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生。其原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
I.已知H2A在水中存在以下平衡:H2A=H++HA-,HA-![]() H++A2-。
H++A2-。
(1)Na2A溶液显____(填“酸性、中性、或碱性”),理由是(用离子方程式表示):_______。
(2)已知0.1mol/L的NaHA溶液的pH=2,则0.1mol/L的H2A溶液中(H+)_____(填“<”“>”或“=”)0.11mol/L,理由是____________。
(3)若向0.1mol/L的H2A溶液中加入等体积等浓度的NaOH溶液,则溶液中各离子浓度由大到小的顺序为______________。
(4)某温度下,纯水中的c(H+)=4.0×10-7mol/L,若温度不变,滴入稀NaOH溶液,使c(OH-)=5.0×10-6moL/L,则溶液的c(H+)=______mol/L;pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa 溶波的pH_____NaOH溶液的pH(填“>”“=”或“<”);
II.含有Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3mol/L的Cr2O72-。为了使废水的排放达标,进行如下处理:
![]()
(5)若处理后的废水中残留的c(Fe3+)=4.0×10-13mol/L,则残留的Cr3+的浓度为____mo/L(已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-33)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中用如图所示装置制取干燥的氨气。
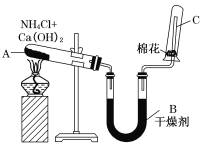
(1)写出A处发生反应的化学方程式: _______________________________。
(2)B中干燥剂为_________________
(3)尾气处理用____________吸收多余的氨气,并且注意防止倒吸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 R2O7n-离子在一定条件下可以把XO32-离子氧化为XO42-,若R2O7n-离子变为R3+离子。又知反应中R2O7n-与XO32-的物质的量之比为1:3,则R2O7n-中R元素的化合价为( )
A.+4B.+5C.+6D.+7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中滴入酚酞试液显红色,该溶液中可以大量共存的离子组是
A.Mg2+、Al3+、HCO3-、SO32- B.K+、Ca2+、MnO4-、Cl-
C.Ba2+、Na+、AlO2-、NO3- D.NH4+、Fe3+、SO42-、SCN-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粗盐中常含有少量的泥沙及氯化钙、氯化镁、硫酸盐等一些可溶性的杂质。粗盐的提纯实验操作步骤如下图所示:
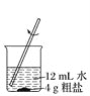

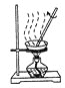
① ② ③
(1)请写出图中各步实验操作的名称①________,②________,③________。
(2)实验操作②的主要目的是____________________。
(3)实验操作③的目的是________________________。
(4)实验操作①②③中都使用的仪器是________,它在③中其作用是____________________。
(5)通过上述实验操作,得到的精盐中可能含有的杂质是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个化学过程的示意图。已知甲池的总反应式为2CH3OH+3O2+4KOH===2K2CO3+6H2O
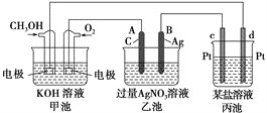
请回答:
(1)甲池是________池,通入O2的电极作为________极,电极反应式为__________。
(2)乙池是________池,A电极名称为________极,电极反应式为_______________。乙池中的总反应离子方程式为_____________________________________________,溶液的pH________(填“增大”、“减小”或“不变”)。
(3)当乙池中B(Ag)极的质量增加5.40 g时,甲池中理论上消耗O2________mL(标准状况下)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com