
氧化亚铜是大型水面舰船防护涂层的重要原料。某小组进行如下研究,请填写下列空白。
实验1:氧化亚铜的制取氧化亚铜可用葡萄糖和新制氢氧化铜悬浊液反应制取。文献表明,条件控制不当时会有少量CuO生成。
(1)实验室制取氢氧化铜悬浊液的离子方程式为____________。
(2)实验室用此方法制取并获得少量氧化亚铜固体,需要的玻璃仪器有试管、酒精灯、烧杯____________和____________。
(3)若要探究该反应发生的最低温度,应选用的加热方式为____________。
实验2:测定氧化亚铜的纯度
方案1:称取实验1所得固体m g,采用如下装置进行实验。
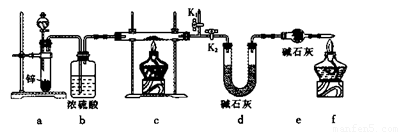
(4)装置a中所加的酸是____________ (填化学式)。
(5)通过测出下列物理量,能达到实验目的的是____________。
A.反应前后装置a的质量
B.装置c充分反应后所得固体的质量
C.反应前后装置d的质量
D.反应前后装置e的质量
(6)在氢气验纯后,点燃装置c中酒精灯之前需要对K1、K2进行的操作是 ____________
方案2:将实验l所得固体mg溶于足量稀硫酸,经过滤、洗涤、干燥后称出不溶物的质量(资料:Cu2O+2H+=Cu2++Cu+H2O)
(7)判断经干燥器干燥后的不溶物是否巳完全干燥的操作方法是__________________________________。
(8)若实验所得不溶物为ng,则该样品中氧化亚铜的质量分数为________________。
(1)Cu2++2OH—=Cu(OH)2↓(2分)
(2)漏斗、玻璃棒(各1分,共2分)
(3)水浴加热(2分)
(4)H2SO4(1分)
(5)BC(选对1个或全选都给2分)
(6)打开K2,关闭K1(2分)
(7)将不溶物再次干燥后称量,直至最后两次质量基本相同(或其他合理答案)(2分)
(8)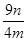 ×100% (或其他合理答案)(2分)
×100% (或其他合理答案)(2分)
【解析】
试题分析:(1)实验室常用可溶性铜盐溶液与氢氧化钠反应制取氢氧化铜,反应式为Cu2++2OH—=Cu(OH)2↓;(2)葡萄糖与新制氢氧化铜混合直接加热需要试管、酒精灯,从液体中分离出Cu2O沉淀需要烧杯、漏斗、玻璃棒;(3)探究该反应发生的最低温度,可以选择水浴加热,需要温度计测量水浴的温度;(4)锌与非氧化性酸、难挥发性酸反应可以制取氢气,则a装置应加入稀H2SO4;(5)装置d增加的质量源自c中反应所生成水,由此可以计算出样品中氧元素的质量,c反应后所得固体的质量等于铜的质量,根据上述两种元素的质量可以测出氧化亚铜的纯度,故BC正确;(6)打开K2,关闭K1,通氢气一会儿后再加热c装置;(7)将不溶物再次干燥后称量,直至最后两次质量基本相同(或其他合理答案),说明不溶物是否巳完全干燥;(8)由m/M可知n(Cu)=n/64mol,由Cu2O+2H+=Cu2++Cu+H2O可知n(Cu2O)=n/64mol,由n•M可知m(Cu2O)=144n/64g=9n/4g,则样品中Cu2O的纯度为9n/4m×100%。
考点:考查物质制备实验、检验样品的纯度、混合物分离和提纯的方法、物质的加热、化学计算等相关知识。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
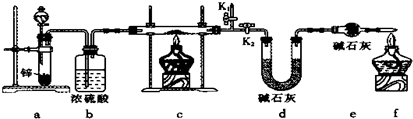
| 9n |
| 4m |
| 9n |
| 4m |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
 (FeSO4?7H2O)一起净水,其原理为
(FeSO4?7H2O)一起净水,其原理为 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH 溶液的pH为
溶液的pH为查看答案和解析>>
科目:高中化学 来源:2012-2013学年四川省广元市高三第二次诊断性考试理综化学试卷(解析版) 题型:实验题
三氧化二铁和氧化亚铜是红色粉末,常作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fc2O3、Cu2O或二者的混合物。探究过程如下:
查阅资料知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
提出假设:假设l:红色粉末是Fc2O3 假设2:红色粉末是Cu2O
假设3:红色粉末是Fc2O3和Cu2O的混合物
设计实验:取少量粉末放人足量稀硫酸中,在所得溶液中再滴加KSCN溶液。
(1)若假设1成立,则实验现象是__ 。
(2)若滴入 KSCN溶液后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?____。筒述你的理由 .
(3)若固体粉末完全溶解无固体存在,滴加KSCN溶液时溶液不变红色,则证明原固体粉末是Fc2O3,和Cu2O的混合物,则其质量比为____,写出其中发生的氧化还原反应的离子方程式 。探究延伸:经实验分析,确定红色粉末为Fc2O3,和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数。取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg ,则混合物中Cu2O的质量分数为
。
,则混合物中Cu2O的质量分数为
。
(5)实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4·5H2O)。经查阅资料得知在溶液中通过调节溶液的酸碱性而使Cu2+、Fe3+、Fe2+分别生成沉淀的pH如下:
|
物 质 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
|
开始沉淀pH |
6.0 |
7.5 |
1.4 |
|
沉淀完全pH |
13 |
14 |
3.7 |
实验室有下列试剂可供选择: A.氯水 B.H2O2 C.NaOH D.Cu2(OH)2CO3
实验小组设计如下实验方案:
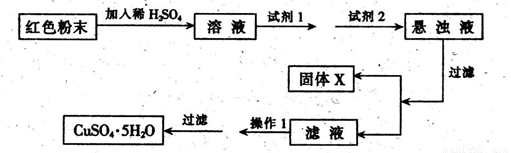
试回答:①试剂1为___ _,试剂2为 (填字母)。
②固体X的化学式为____,③操作I为_ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某红色固体的成分可能是氧化亚铜、铜或三氧化二铁中的一种或几种。某学校化学科研小组欲探究该红色固体的成分。请你参与该活动,并完成相关实验设计。
查资料知道,氧化亚铜是一种碱性氧化物,溶于稀硫酸生成铜和硫酸铜,在空气中加热生成氧化铜。
(1)甲同学认为,取少量固体,加入足量稀硫酸,充分搅拌后,取该溶液少量,置于一洁净的试管中,滴加硫氰化钾溶液,如溶液不变红色,证明原固体中一不定期不含三氧化二铁。你认为这种说法合理吗? 。简述你的理由(不需写出反应的方程式): 。
(2)乙同学认为,取少量固体溶液稀硫酸,若固体全部溶解,就说明一定没有铜和氧化亚铜。这种说法不合理。在此实验过程中,可能发生如下反应(用离子方程式表示):
。
(3)丙同学经分析确定该固体的成分是氧化亚铜和铜。他想通过实验测定两种物质的质量分数。请你帮他设计一个实验方案,写出实验涉及到反应的化学方程式:以a、b、c……代表实验测出相应的数据,写出氧化亚铜的质量分数的表达式。
化学方程式: 。
氧化亚铜的质量分数的表达式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com