
分析 (1)溶液c(Cu2+)=n(Cu),由电荷守恒可知溶液中c(NO3-)=c(H+)+2c(Cu2+),据此计算c(H+);
(2)根据N元素守恒,可知n(NO2)+n(NO)=n硝酸溶液(HNO3)-n反应后溶液(NO3-),令NO2、NO的物质的量分别为xmol、ymol,利用电子转移守恒、二者的物质的量之和列方程计算.
(3)反应后为NaNO2、NaNO3混合溶液,根据N元素守恒可知,n(NaNO2)+n(NaNO3)=n(NO2)+n(NO),根据钠元素守恒可知,n(NaOH)=n(NaNO2)+n(NaNO3),再根据V=$\frac{n}{c}$计算.
解答 解:(1)6.4g Cu的物质的量为$\frac{6.4g}{64g/mol}$=0.1mol,所以溶液n(Cu2+)=n(Cu)=0.1mol,溶液中c(NO3-)=c(H+)+2c(Cu2+),所以溶液中c(H+)=2c(Cu2+)-c(NO3-)=$\frac{0.1mol}{0.05L}$×2-3mol/L=1mol/L,
答:稀释后的溶液中H+的物质的量浓度为1mol/L;
(2)根据N元素守恒,可知n(NO2)+n(NO)=n硝酸溶液(HNO3)-n反应后溶液(NO3-)=0.05L×9mol/L=0.45mol-0.1L×3mol/L=0.15mol,
令NO2、NO的物质的量分别为xmol、ymol,则:
$\left\{\begin{array}{l}{x+y=0.15}\\{x+3y=0.1×2}\end{array}\right.$,
解得x=0.125,y=0.025.
答:气体中NO2的物质的量为0.125mol;
(3)反应后为NaNO2、NaNO3混合溶液,根据N元素守恒可知,n(NaNO2)+n(NaNO3)=n(NO2)+n(NO)=0.15mol,根据钠元素守恒可知,n(NaOH)=n(NaNO2)+n(NaNO3)=0.15mol,NaOH溶液的体积为$\frac{0.15mol}{1L}$=0.15L=150mL,
答:需要NaOH溶液的体积为150mL.
点评 本题考查氧化还原反应的有关计算,为高频考点,把握发生的反应、原子守恒、电荷守恒、原子守恒等为解答的关键,侧重守恒法及分析、计算能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2 | B. | HCOOCH3 | C. | CH3COOCH2CH2CH3 | D. | CH3 CH2CH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
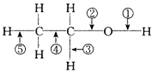
| A. | 和金属钠作用时,键①断裂 | |
| B. | 和浓硫酸共热至170℃时,键②和⑤断裂 | |
| C. | 和乙酸、浓硫酸共热时,键②断裂 | |
| D. | 在铜催化下和氧气反应时,键①和③断裂 E、与氢卤酸反应时,键②断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池的正极发生氧化反应 | |
| B. | 原电池的负极发生氧化反应 | |
| C. | 发生原电池反应时,溶液中的阳离子向负极定向移动 | |
| D. |  如图,可观察到灵敏检流计的指针不偏转 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量大于546.6 kJ | |
| B. | 44.8L氟化氢气体分解成22.4L的氢气和22.4L的氟气吸收546.6 kJ热量 | |
| C. | 相同条件下,1mol氢气与1mol氟气的能量总和高于2mol氟化氢气体的能量 | |
| D. | 2molH-F键的键能比1molH-H键和1mol F-F键的键能之和大546.6kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com