
【题目】在一定温度、压强下,向密闭容器中投入一定量N2和H2,发生反应:N2+3H2![]() 2NH3 △H<0。
2NH3 △H<0。
(1)反应开始阶段,v(正)_______(填“>”“<”或“=”)v(逆),随后v(正)________逐渐(填“增大”或“减小”,下同),v(逆)逐渐_______,反应达到平衡时,v(正)_______(填“>”“<”或“=”)v(逆)。
(2)达到平衡后,若正反应速率用v(N2)表示,逆反应速率用v’(H2)表示,则v(N2)=____v’(H2)。
(3)下列措施中能加快反应速率并提高氢气的转化率的是_______(填字母)。
A 其他条件不变时,压缩容器体积 B 其他条件不变时,升高反应体系温度
C 使用合适的催化剂 D 保持容器体积不变,充入一定量的氮气
(4)实际生产中往往需要将温度控制在一个合适的范围,分析温度不宜过高也不宜过低的原因是_____。
【答案】> 减小 增大 = ![]() AD 温度过低,化学反应速率慢,氨气的生成效率低;温度过高,平衡逆向移动,产物的转化率低。
AD 温度过低,化学反应速率慢,氨气的生成效率低;温度过高,平衡逆向移动,产物的转化率低。
【解析】
(1)反应开始时,加入N2和H2,反应朝着正反应方向进行, v(正)> v(逆);开始时,反应物浓度最大,随着反应的进行,反应物浓度减小,生成物浓度增大,则v(正)减小,v(逆)增大;达到平衡时,正反应速率等于逆反应速率,则v(正)= v(逆);
(2)达到平衡时,正反应速率等于逆反应速率,但是同一化学反应中,用不同的物质表示化学反应速率,其数值之比等于计量数之比,即v正(N2)=v逆(N2)=![]() v’(H2);
v’(H2);
(3) A、其他条件不变时,压缩容器体积,各反应物的浓度增大,化学反应速率增大;压缩体积,压强增大,平衡向气体体积减小的方向移动,即正反应方向移动,氢气转化率增大,A符合题意;
B、其他条件不变时,升高反应体系温度,升高温度,化学反应速率增大;升高温度,平衡向吸热反应方向移动,即逆反应方向移动,则H2的转化率减小,B不符合题意;
C、使用合适的催化剂,化学反应速率增大;但是催化剂不改变化学平衡,则H2的转化率不变,C不符合题意;
D、保持容器体积不变,充入一定量的氮气,反应物浓度增大,化学反应速率增加;增大反应物浓度,平衡正向移动,H2的转化率增加,D符合题意;
答案选AD;
(4)工业生产氨气,温度不能过低,温度过低,催化剂活性低,化学反应速率慢,氨气生产效率低下;合成氨反应是放热反应,温度过高,平衡逆向移动,反应物转化率低,所以温度需要控制在一定范围,不能过高也不能过低。


 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题:
已知化学键键能数据如表:
化学健 | C﹣H | C=O | H﹣H | C≡O(CO) | ||
键能(kJ/mol) | 413 | 745 | 436 | 1075 |
(1)①CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)。则该反应的△H=_____________。
2CO(g)+2H2(g)。则该反应的△H=_____________。
②在恒容绝热条件下,一定能说明该反应已达平衡状态的是_____________。(填字母)
A.混合气体的密度不再变化B.混合气体的平均相对分子质量不再变化
C.容器内的温度不再变化D.v正(CH4)=2v逆(H2)
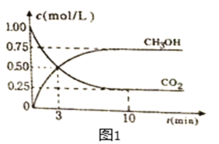
(2)利用CO2可制取甲醇,其反应为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g);△H=-49.0KJ/mol;为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在恒温恒容密闭容器中,充入2molCO2和6molH2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图1所示。从反应开始到平衡,v(H2)=_____________;该温度下的平衡常数数值=_____________(保留三位有效数字)。
CH3OH(g)+H2O(g);△H=-49.0KJ/mol;为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在恒温恒容密闭容器中,充入2molCO2和6molH2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图1所示。从反应开始到平衡,v(H2)=_____________;该温度下的平衡常数数值=_____________(保留三位有效数字)。
(3)下列措施能使![]() 增大的是________。
增大的是________。
A.降低温度
B.恒温恒容下,再充入2molCO2、6molH2
C.使用高效催化剂
D.恒温恒容充入He(g)使体系压强增大
(4)一种熔融碳酸盐燃料电池原理示意如图2。
①该电池的负极反应式为_____________
②电池工作时,CO32﹣向电极_____________移动(填A或者B)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施或事实不能用勒夏特列原理解释的是
A.新制的氯水在光照下颜色变浅
B.H2、I2、HI平衡混合气加压后颜色变深
C.在合成氨的反应中,加压有利于氨的合成
D.Fe(SCN)3溶液中加入NaOH后溶液颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合元素周期表,完成下列问题。
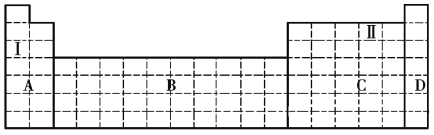
(1)在元素周期表中全部是金属元素的区域为______(填序号)。
a.A b.B c.C d.D
(2)Ⅰ和Ⅱ元素形成的化合物的化学式为______、______,它们都是____________(填“共价化合物”或“离子化合物”)。
(3)现有甲、乙两种元素,在火山口和火山附近的温泉中有甲元素的单质出现,乙元素是唯一一种原子序数比甲元素大的短周期主族元素。
①将甲、乙两元素的元素符号填写在上面元素周期表中对应的位置。______
②甲、乙两元素中,非金属性较强的是______(填元素名称),可以验证该结论的实验现象是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3Cl2+6NaOH![]() 5NaCl+NaClO3+3H2O,以下叙述正确的是( )
5NaCl+NaClO3+3H2O,以下叙述正确的是( )
A.Cl2是氧化剂,NaOH是还原剂
B.被氧化的氯原子和被还原的氯原子的物质的量之比为5∶1
C.Cl2既做氧化剂又做还原剂
D.氧化剂得电子数与还原剂失电子数之比为5∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一化合物X,其水溶液为浅绿色,可发生如下的转化关系(部分反应物、生成物已略)。其中B、D、E、F均为无色气体,M、L为常见的金属单质,C为难溶于水的红褐色固体。在混合液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀,H和M反应可放出大量的热。请回答下列问题:
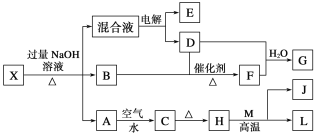
(1)B的电子式为____________。
(2)电解混合液时阳极反应式为_______________________。
(3)写出L长期放置在潮湿空气中的腐蚀原理:
负极:___________________________________。
正极:___________________________________。
总反应:______________________________________________________。
(4)已知a g E气体在D中完全燃烧生成稳定的化合物时,放出b kJ的热量,写出E气体燃烧热的热化学方程式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一个有机物的核磁共振氢谱图,请你观察图谱,分析其可能是下列物质中的 ( )
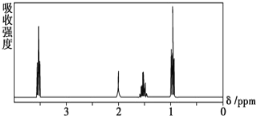
A.CH3CH2CH2CH3B.(CH3)3CCH3
C.CH3CH2CH2OHD.CH3CH2COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示配制100mL0.100molL﹣1Na2CO3溶液的几个关键实验步骤和操作,据图回答下列问题:

(1)用容量瓶配制一定物质的量浓度的溶液,该容量瓶必须是_____。
①干燥的 ②瓶塞不漏水的 ③用欲配制的溶液润洗过的 ④以上三项均须要求的
(2)若用Na2CO310H2O来配制溶液,需要称量晶体_____克。若所称取的晶体已经有一部分失去了结晶水,则所配制的溶液浓度偏_____。(填“大/小”)
(3)写出配制溶液中所需要用到的玻璃仪器的名称:烧杯、_____。
(4)步骤B通常称为转移,步骤A通常称为_____。步骤D称为_____,若没有步骤D,则配制的浓度偏_____。(填“大/小”)。
(5)将上述实验步骤A﹣F按实验过程先后次序排列_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像表示向AlCl3溶液中滴加NaOH溶液的过程中或向NaAlO2溶液中滴加稀盐酸的过程中Al3+与![]() 物质的量的变化曲线,实线表示Al3+物质的量的变化,虚线表示
物质的量的变化曲线,实线表示Al3+物质的量的变化,虚线表示![]() 物质的量的变化。其中正确的是( )
物质的量的变化。其中正确的是( )
A.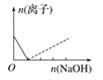 B.
B.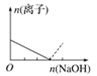 C.
C.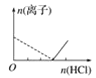 D.
D.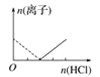
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com