
| A. | 可用丁达尔效应区分溶液和胶体 | |
| B. | 胶体能透过半透膜,但不能透过滤纸 | |
| C. | Fe(OH)3胶体的电泳实验说明了胶体粒子带有电荷 | |
| D. | 江河入海口三角洲的形成,通常与胶体的性质有关 |
分析 A.胶体具有丁达尔现象,而溶液不具有;
B.胶体粒子的大小在1-100nm之间;
C.电泳实验说明了胶体微粒带电荷;
D.江河入海口三角洲的形成是由于胶体的聚沉.
解答 解:A.胶体具有丁达尔现象,而溶液不具有,则可用丁达尔效应区分溶液和胶体,故A正确;
B.胶体粒子的大小在1-100nm之间,可以透过滤纸但不能透过半透膜,故B错误;
C.电泳实验说明了胶体微粒可吸附离子带电荷,在外加电场的作用下会发生定向移动,故C正确;
D.江河水中的泥沙是胶体,遇到海水中的电解质发生了聚沉,日积月累,形成了三角洲,故D正确.
故选B.
点评 本题考查了分散系的分类,及胶体的性质,题目比较基础,侧重于基础知识的考查.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:选择题
| A. | 向NaHSO4溶液中滴加过量Ba(OH)2溶液:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O | |
| B. | 向碳酸氢钠溶液中加入氢氧化钠:HCO3-+OH-=CO2↑+H2O | |
| C. | 向FeCl3溶液中加入铜片:Fe3++Cu=Fe2++Cu2+ | |
| D. | 用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O=2HCO3-+SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 | |
| B. | 相同温度下,将足量氯化银固体分别加入:①蒸馏水、②0.1 mol•L-1氯化镁溶液、③0.1 mol•L-1盐酸、④0.1 mol•L-1硝酸银溶液中,充分溶解后Ag+浓度:①>③=④>② | |
| C. | 室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后溶液的pH<7 | |
| D. | 为确定某酸H2A是强酸还是弱酸,可测定室温时NaHA溶液的pH.若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
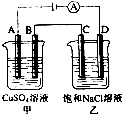 如图两个电解槽中,A、B、C、D均为石墨电极.若电解过程中共有0.02mol电子通过,下列叙述中不正确的是( )
如图两个电解槽中,A、B、C、D均为石墨电极.若电解过程中共有0.02mol电子通过,下列叙述中不正确的是( )| A. | 甲烧杯中B极上最多可析出铜0.64g | |
| B. | 甲烧杯中A极上电极反应式4OH--4 e-═2H2O+O2↑ | |
| C. | 烧杯中D极上电极反应式为4H++4 e-═2H2↑ | |
| D. | 乙烧杯中滴入酚酞试液,C极附近先变红 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com