
【题目】合成氨是人类科学技术上的一项重大突破,其反应原理为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1
(1)已知:2H2(g)+O2(g)![]() 2H2O(g) ΔH=-483.6 kJ·mol-1。则4NH3(g)+3O2(g)
2H2O(g) ΔH=-483.6 kJ·mol-1。则4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) ΔH=______kJ·mol-1。
2N2(g)+6H2O(g) ΔH=______kJ·mol-1。
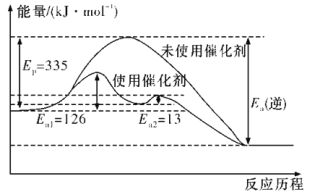
(2)如图所示,合成氨反应中未使用催化剂时,逆反应的活化能Ea(逆)=__kJ·mol-1;使用催化剂之后,正反应的活化能为___kJ·mol-1(已知:加入催化剂后,反应分两步进行,反应的活化能是两个过程中需要吸收能量较大的反应的活化能)。
(3)从平衡视角考虑,工业合成氨应该选择常温条件,但实际工业生产却选择500 ℃左右的高温,试解释其原因: ____________________________。
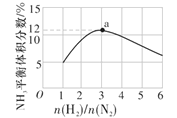
(4)如图表示500 ℃、60 MPa条件下,原料气投料比与平衡时NH3的体积分数的关系。根据图中a点数据计算N2的平衡体积分数为__。
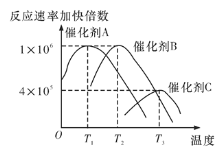
(5)合成氨需要选择合适的催化剂,分别选用A、B、C三种催化剂进行实验,所得结果如图所示(其他条件相同),则实际生产中适宜选择的催化剂是__(填“A”“B”或“C”),理由是________。
(6)如图是当反应器中按n(N2)∶n(H2)=1∶3投料后,在200 ℃、400 ℃、600 ℃反应达到平衡时,混合物中NH3的物质的量分数随总压强的变化曲线。
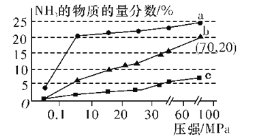
①曲线a、b对应温度较高的是___(填“a”或“b”)。
②列出b点平衡常数的计算式Kp=____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;不要求计算结果)。
【答案】-1266 427.4 126 从反应速率角度考虑,反应温度越高,反应速率越快;从催化剂活性角度考虑,500℃左右催化剂活性较高;温度过高,平衡将逐渐逆向移动,不利于氨的合成 22% A 催化剂A在较低温度下具有较高的催化活性,一方面可节约能源,另一方面低温有利于氨的合成 b ![]() (或
(或![]() )
)
【解析】
(1)将题给已知热化学方程式依次编号为Ⅰ、Ⅱ,根据盖斯定律,由3×Ⅱ-2×Ⅰ可得4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g)ΔH=(-483.6 kJ·mol-1)×3+92.4 kJ·mol-1×2=-1266 kJ·mol-1;
2N2(g)+6H2O(g)ΔH=(-483.6 kJ·mol-1)×3+92.4 kJ·mol-1×2=-1266 kJ·mol-1;
(2)根据ΔH=正反应的活化能-逆反应的活化能可知,合成氨反应中未使用催化剂时,逆反应的活化能Ea(逆)=(335+92.4)kJ·mol-1=427.4 kJ·mol-1;由图1及括号内的已知信息可知,使用催化剂之后,正反应的活化能为126 kJ·mol-1;
(3)反应温度越高,反应速率越快,且在500 ℃左右催化剂活性较高,若温度过高,平衡将逐渐逆向移动,不利于氨的合成,所以在实际工业生产中选择500 ℃左右的高温;
(4)根据图2中的数据可知,a点时NH3的平衡体积分数为12%,投料比n(N2)∶n(H2)=1∶3,
解法一:设起始加入的N2为1 mol,参与反应的N2为n mol,根据三段式法有:
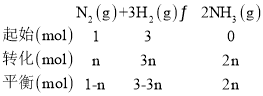
则![]() =12%,解得n=
=12%,解得n=![]() ,N2的平衡体积分数为
,N2的平衡体积分数为![]() =22%。
=22%。
解法二:起始投料比等于化学计量数之比,则N2的平衡体积分数为(1-12%)×![]() =22%。
=22%。
(5)由图3可知,催化剂A在较低温度下具有较高的催化活性,且合成氨反应是放热反应,低温对氨的合成有利,所以实际生产中适宜选择的催化剂是A;
(6)①合成氨反应为放热反应,升高温度,平衡逆向移动,NH3的物质的量分数减小,故曲线a、b对应温度较高的是b;
②根据图4中的数据可知,b点时NH3的平衡物质的量分数为20%,总压强p=70 MPa。
解法一:设起始加入的N2为1 mol,反应的N2为m mol,则根据三段式法有:

则![]() =20%,解得m=
=20%,解得m=![]() ,所以b点时,NH3和N2的物质的量分数均为20%,H2的物质的量分数为60%,则Kp=
,所以b点时,NH3和N2的物质的量分数均为20%,H2的物质的量分数为60%,则Kp=![]() (或
(或![]() );
);
解法二:起始投料比等于化学计量数之比,则b点时N2的物质的量分数为(1-20%)×![]() =20%,H2的物质的量分数为20%×3=60%,则Kp=
=20%,H2的物质的量分数为20%×3=60%,则Kp=![]() (或
(或![]() )。
)。


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】![]() 是一种常见的化学试剂,是制备其他含锰化合物的重要原料。某课外化学兴趣小组利用软锰矿
是一种常见的化学试剂,是制备其他含锰化合物的重要原料。某课外化学兴趣小组利用软锰矿![]() 主要成分为
主要成分为![]() ,含少量
,含少量![]() 、
、![]() 和
和![]() 制备
制备![]() ,设计流程如图:
,设计流程如图:![]() 注:试剂①②③按编号顺序加入
注:试剂①②③按编号顺序加入![]()

已知:常温时部分难溶化合物的![]() 近似值
近似值![]() 如表:
如表:
物质 |
|
|
|
|
|
|
|
|
|
|
|
(1)该小组同学在酸浸之前,先将软锰矿粉碎,其目的是________。
(2)“酸浸”过程中![]() 发生反应的离子方程式为________。
发生反应的离子方程式为________。
(3)加入![]() 固体的作用是________,甲同学提出将上述流程中的氨水换成氢氧化钠溶液,乙同学觉得不妥,乙同学的理由是________。
固体的作用是________,甲同学提出将上述流程中的氨水换成氢氧化钠溶液,乙同学觉得不妥,乙同学的理由是________。
(4)丙同学认为向滤液C中滴加![]() 溶液的过程中可能会生成
溶液的过程中可能会生成![]() 沉淀,并提出可能的原因为
沉淀,并提出可能的原因为![]() ,常温时,该反应的平衡常数
,常温时,该反应的平衡常数![]() ________
________![]() 填数值
填数值![]() 。
。![]() 已知
已知![]() ,
,![]() 。
。
(5)操作Ⅰ的名称为________。
(6)如图是小组同学将![]() 晶体放在坩埚里加热分解时,固体失重质量分数随温度
晶体放在坩埚里加热分解时,固体失重质量分数随温度![]() 变化的曲线
变化的曲线![]() 已知草酸锰不稳定,但其中锰元素的化合价在
已知草酸锰不稳定,但其中锰元素的化合价在![]() 以下不变
以下不变![]() 。
。
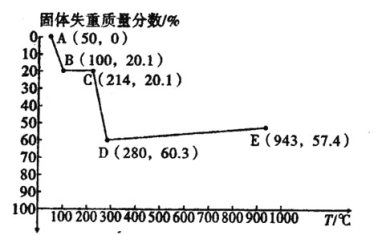
试根据各点的坐标![]() 近似值
近似值![]() 回答下列问题:
回答下列问题:
①![]() 的化学方程式为________。
的化学方程式为________。
②从D点到E点过程中固体失重的质量分数下降的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以红土镍矿(主要含有Fe2O3、FeO、NiO、SiO2等)为原料,获取净水剂黄钠铁矾[NaFe(SO4)2(OH)6]和纳米镍粉的部分工艺流程如下:

(1)“酸浸”过程,为提高铁和镍元素的浸出率,可采取的措施有___________(写出两种)。
(2)“过滤Ⅰ”滤渣的主要成分是______。
(3)“氧化”过程欲使0.3molFe2+转变为Fe3+,则需氧化剂NaClO至少为________ mol。
(4)“沉铁”过程中加入碳酸钠调节浴液的pH至2,生成黃钠铁矾沉淀,写出该反应的化学方程式______。若碳酸钠过多会导致生成的沉淀由黄钠铁矾转变为_____(填化学式)。
(5)向“过滤Ⅱ”所得滤液(富含Ni2+)中加入N2H4·H2O,在不同浓度的氢氧化钠溶液中反应,含镍产物的XRD图谱如下图所示(XRD图谱可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。欲制得高纯纳米镍粉最适宜的NaOH的物质的量浓度为_____。写出该条件下制备纳米镍粉同时生成N2的离子方程式_____。

(6)高铁酸盐也是一种优良的含铁净水剂,J.C.Poggendor早在1841年利用纯铁作电极插入浓的NaOH溶液电解制得Na2FeO4,阳极生成FeO42-的电极反应式为______;Deininger等对其进行改进,在阴、阳电极间设置阳离子交换膜,有效提高了产率,阳离子交换膜的作用是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如图所示变化规律(p表示压强,T表示温度,n表示物质的量):根据以上规律判断,下列结论正确的是( )
A. 反应Ⅰ:△H>0,p2>p1
反应Ⅰ:△H>0,p2>p1
B. 反应Ⅱ:△H>0,T1>T2
反应Ⅱ:△H>0,T1>T2
C. 反应Ⅲ:△H>0,T2>T1或△H<0,T2<T1
反应Ⅲ:△H>0,T2>T1或△H<0,T2<T1
D. 反应Ⅳ:△H<0,T2>T1
反应Ⅳ:△H<0,T2>T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下事实不能用勒夏特列原理解释的是( )
A.增大压强,有利于二氧化硫和氧气反应生成三氧化硫
B.工业制取硫酸和合成氨反应都要使用催化剂
C.合成氨工业生产中,把合成塔中的氨气不断抽出
D.实验室常用排饱和食盐水的方法收集氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡是世界三大饮料之一,因其含有咖啡因(结构简式为![]() )使人神经兴奋,影响人的睡眠。最近科学家用超临界二氧化碳提取咖啡因,成功制得了无因咖啡。下列说法错误的是()
)使人神经兴奋,影响人的睡眠。最近科学家用超临界二氧化碳提取咖啡因,成功制得了无因咖啡。下列说法错误的是()
A.咖啡因的化学式为C8H10N4O2
B.咖啡因是可溶于水的高分子化合物
C.咖啡因在一定条件下可与氢气发生加成反应
D.超临界二氧化碳提取咖啡因的操作是萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关概念或原理的叙述正确的是 ( )
A.氨基酸、蛋白质和氧化铝一样既能与酸反应,又能与碱反应,所以它们都是两性氧化物
B.制造婴儿用的一次性纸尿片采用的吸水保水的材料可以是![]()
C.乙烯和聚乙烯都能使酸性![]() 溶液褪色
溶液褪色
D.甲酸乙酯、葡萄糖、麦芽糖、淀粉这四种物质的共同性质是,它们既可以发生水解反应,又可以发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋动物海鞘中含有种类丰富、结构新颖的次生代谢产物,是海洋抗肿瘤活性物质的重要来源之一。一种从海鞘中提取具有抗肿瘤活性的天然产物的流程如下:
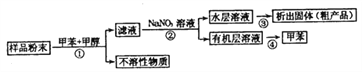
下列关于该流程中各步骤的说法中,错误的是( )
选项 | 步骤 | 采用装置 | 主要仪器 |
A | ① | 过滤装置 | 漏斗 |
B | ② | 分液装置 | 分液漏斗 |
C | ③ | 蒸发装置 | 坩埚 |
D | ④ | 蒸馏装置 | 蒸馏烧瓶 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组对人教版教材实验“在200mL烧杯中放入20g蔗糖(C12H22O11),加入适量水,搅拌均匀,然后再加入15mL质量分数为98%浓硫酸,迅速搅拌”进行如下探究;
(1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味,按压此黑色物质时,感觉较硬,放在水中呈漂浮状态,同学们由上述现象推测出下列结论:
①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③浓硫酸具有脱水性④浓硫酸具有酸性 ⑤黑色物质具有强吸附性
其中依据不充分的是_________(填序号);
(2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:

试回答下列问题:
①图1的A中最好选用下列装置_________(填编号);
②图1的 B装置所装试剂是_________;D装置中试剂的作用是_________;E装置中发生的现象是_________;
③图1的A装置中使蔗糖先变黑的化学反应方程式为_________,后体积膨胀的化学方程式为:_________;
④某学生按图2进行实验时,发现D瓶品红不褪色,E装置中有气体逸出,F装置中酸性高锰酸钾溶液颜色变浅,推测F装置中酸性高锰酸钾溶液颜色变浅的原因_________,其反应的离子方程式是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com