
已知五种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.104 | 0.111 | 0.066 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
科目:高中化学 来源: 题型:单选题
关于919F-微粒叙述正确的是( )
| A.质量数为19,电子数为9 | B.质子数为9,中子数为10 |
| C.质子数为9,电子数为9 | D.中子数为10,电子数为8 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
元素A和B的原子序数都小于18。已知A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M层电子数为(a-b),L层电子数为(a+b),则A、B两元素所形成的化合物的晶体类型为( )
A.分子晶体 B.离子晶体 C.原子晶体 D.金属晶体
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
1919年,科学家第一次实现了人类多年的梦想——人工转变元素。这个核反应如下: N+
N+ He―→
He―→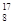 O+
O+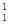 H,下列叙述正确的是( )
H,下列叙述正确的是( )
A.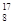 O原子核内有9个质子 O原子核内有9个质子 |
B.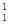 H原子核内有1个中子 H原子核内有1个中子 |
| C.O2和O3互为同位素 |
| D.通常情况下,He和N2化学性质都很稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于碱金属元素和卤素的说法中,错误的是( )
| A.随核电荷数的增加,碱金属元素和卤素的熔沸点都逐渐降低 |
| B.碱金属元素中,锂原子失去最外层电子的能力最弱;卤素中,氟原子得电子的能力最强 |
| C.钾与水的反应比钠与水的反应更剧烈 |
| D.溴单质与H2的反应比碘单质与H2的反应更剧烈 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列叙述中,正确的是
| A.在一个基态多电子的原子中,可以有两个运动状态完全相同的电子 |
| B.在一个基态多电子的原子中,不可能有两个能量完全相同的电子 |
| C.如果某一基态原子3p轨道上仅有2个电子,它们自旋方向必然相反 |
| D.在一个基态多电子的原子中,M层上的电子能量肯定比L层上的电子能量高 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
应用元素周期表和元素周期律分析下列推断,其中正确的组合是
①根据元素周期律,由HClO4可类推出氟元素也存在HFO4
②在元素周期表的金属和非金属分界线附近寻找半导体材料
③铊(Tl)与铝同主族,原子核外有6个电子层,推测Tl(OH)3是两性氢氧化物
④碱金属单质和卤素单质的熔点都随原子序数的增大而增大
⑤砹(At)是VIIA族元素,其氢化物的稳定性大于HC1
⑥第三周期金属元素的最高价氧化物对应水化物,其碱性随原子序数的增大而减弱
| A.②⑥ | B.①③④ | C.②③⑤ | D.④⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com