
分析 用适量水稀释0.1mol/L氨水时,溶液中随着水量的增加,一水合氨的电离程度增大,则氢氧根离子、铵根离子的物质的量增大,但氢氧根离子的浓度会减小,据此进行判断.
解答 解:①稀释过程中一水合氨的电离程度增大,则氢氧根离子的物质的量增大,故答案为:增大;
②稀释过程中NNH3•H2O的电离程度增大,NNH3•H2O物质的量减小、氢氧根离子的物质的量增大,所以$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$ 增大,故答案为:增大;
③一水合氨的电离常数k=$\frac{c(N{{H}_{4}}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不随浓度的变化而变化,所以$\frac{c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})•c(O{H}^{-})}$ 也是一个常数,即不变;
故答案为:不变.
点评 本题考查了弱电解质的电离平衡及其影响,题目难度不大,明确电离平衡及其影响因素为解答关键,注意稀释过程中一水合氨的电离程度增大,试题培养了学生的分析能力及灵活应用能力.


 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:解答题
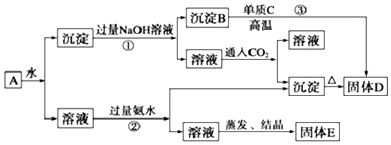
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
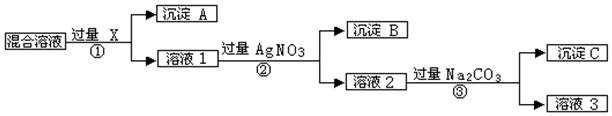
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
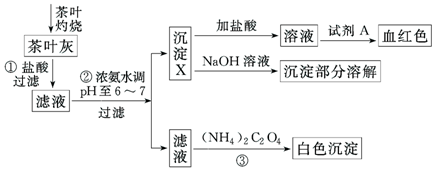
| Ca(OH)2 | Al(OH)3 | Fe(OH)3 | |
| pH | ≥13 | ≥5.2 | ≥4.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
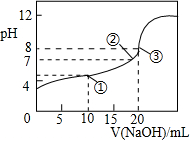 25℃时,向20.00mL0.1mol•L-1HClO2溶液中逐滴加入0.1mol•L-1的NaOH溶液.溶液的pH与滴入NaOH溶液的体积的关系如图所示,则下列说法中不正确的是( )
25℃时,向20.00mL0.1mol•L-1HClO2溶液中逐滴加入0.1mol•L-1的NaOH溶液.溶液的pH与滴入NaOH溶液的体积的关系如图所示,则下列说法中不正确的是( )| A. | ①点时:c(ClO2-)>c(Na+)>c(H+)>c(OH-) | |
| B. | ②点时:c(Na+)=c(ClO2-) | |
| C. | ③点时:c(H+)=c(OH-)+c(HClO2) | |
| D. | 滴定过程中可能出现:c(Na+)>c(ClO2-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
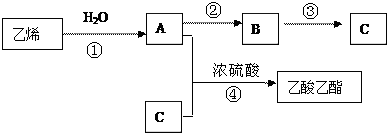
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
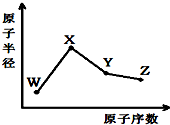 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.回答下列问题:
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在强碱溶液中NaClO与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3+4OH-═2FeO42-+3Cl-+5H2O | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 铜溶于浓硝酸:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| D. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

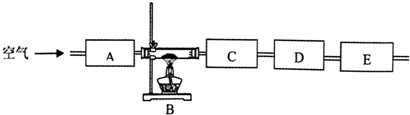
| 仪器 编号 | 药品 | 目的 |
| A | 碱石灰 | |
| B | 绿色固体 | |
| C | ||
| D | ||
| E | 碱石灰 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com