
【题目】已知在温度低于570°C时,还原铁粉与水蒸气反应的产物是FeO;高于570°C时,生成Fe3O4。老师用如图所示实验装置,完成了还原铁粉与水蒸气反应的演示实验。

甲同学为探究实验后试管内固体的成分,进行了下列实验:

试回答下列问题:
(1)湿棉花的作用是_______________________________________________________ 。
(2)写出高于570°C时,Fe与水蒸气反应的化学方程式:______________________________________。
(3)乙同学认为加入KSCN溶液没有出现血红色原因可能是固体中没有Fe3O4,也有可能是因为______(填物质名称)过量造成的。该物质过量时,溶液中还会发生反应,导致加入KSCN溶液时没有出现血红色,该反应的离子方程式是___________________________________________________。
(4)丙同学利用上述实验①加盐酸后的溶液制取白色的Fe(OH)2沉淀,向滤液中加入足量NaOH溶液后,观察到的实验现象为_____________________________________________________________。
【答案】提供反应所需水蒸气 3Fe+4H2O(g)![]() Fe3O4+4H2 铁粉 2Fe3+ +Fe=3Fe2+ 先生成白色沉淀,后沉淀迅速变为灰绿色,最终变为红褐色
Fe3O4+4H2 铁粉 2Fe3+ +Fe=3Fe2+ 先生成白色沉淀,后沉淀迅速变为灰绿色,最终变为红褐色
【解析】
(1)湿棉花在加热时水蒸发形成水蒸气;故答案为:提供反应所需的水蒸气;
(2)高于570°C时,铁与水蒸气在高温条件下可以发生反应生成四氧化三铁和氢气,化学方程式:3Fe+4H2O(g)![]() Fe3O4+4H2。故答案为:3Fe+4H2O(g)
Fe3O4+4H2。故答案为:3Fe+4H2O(g)![]() Fe3O4+4H2;
Fe3O4+4H2;
(3)过量铁粉会与三价铁反应,生成二价铁,该反应的离子方程式是2Fe3+ +Fe=3Fe2+。故答案为:铁粉;2Fe3+ +Fe=3Fe2+;
(4)上述实验①加盐酸后的溶液呈浅绿色,说明含有二价铁,加盐酸后的溶液制取白色的Fe(OH)2沉淀,向滤液中加入足量NaOH溶液后,观察到的实验现象为先生成白色沉淀,后沉淀迅速变为灰绿色,最终变为红褐色。故答案为:先生成白色沉淀,后沉淀迅速变为灰绿色,最终变为红褐色。


科目:高中化学 来源: 题型:
【题目】某研究性学习小组利用浓硫酸和乙醇制取乙烯,并验证探究乙烯与溴反应。实验装置如下(省略夹持、搅拌、加热装置)。
装置1 装置2
装置2 
请回答:
(1)仪器b的名称是_________;
(2)加热前,需将乙醇和浓硫酸混合。仪器a中盛装的是_________;
(3)乙醇制取乙烯的化学反应方程式为_________________;
(4)实验结果讨论:①甲同学观察到装置1中溴水颜色褪去,认为乙烯与溴水发生加成反应。化学反应方程式为____;
②乙同学观察到反应混合液逐渐变黑,认为乙烯中可能混有一种还原性气体,它也能使溴水颜色褪去。为证明乙烯能使溴水褪色,需将装置1虚线部分换成装置2,重做实验。装置2中,C所盛试剂是___;
③丙同学认为甲同学在观察实验现象时,漏掉一个能够证明乙烯与溴水发生了反应的重要实验现象。该现象是指_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为“铁链环”结构,图中两环相交部分A、B、C、D表示物质间的反应。下列对应部分反应的离子方程式书写正确的是
![]()
A.C12+2OH-=Cl-+ClO-+2H2OB.Cu2++2OH-=Cu(OH)2↓
C.SO42-+Ba2+=BaSO4↓D.OH-+HCO3-=H2O+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法正确的是
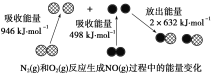
A.1 mol N2(g)和NA个 O2(g)反应放出的能量为180 kJ
B.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量
C.通常情况下,N2(g)和O2(g)混合能直接生成NO
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.将如图装置放置在光亮的地方,随后观察到如下实验现象:大试管内壁上有油状液滴生成、饱和食盐水中有少量固体析出、黄绿色气体颜色变浅、试管内液面有所上升。
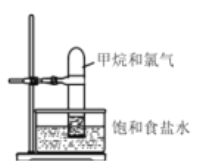
(1)油状液滴中属于非极性分子的电子式为________。
(2)水槽中盛放饱和食盐水而不是蒸馏水是为了抑制________与水的反应。试管内液面上升的原因是________极易溶于水。
II.乙烯是一种重要的化工原料,以乙烯为原料生产部分化工产品的反应如下(部分反应条件已略去):
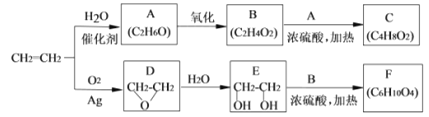
请回答下列问题:
(3)A的名称是________,含有的官能团名称是________。实验室A转化为乙烯的反应条件为________。
(4)B和A反应生成C的化学方程式为________,该反应的类型为________。
(5)F的结构简式为______________。
(6)写出D的同分异构体的结构简式__________________。
(7)乙炔也是常见的一种化工原料,它可以制取很多化工产品,例如:聚氯乙烯塑料。写出乙炔合成聚氯乙烯的合成路线。(合成路线常用的表示方式为:A![]() B
B![]() ……目标产物)______________
……目标产物)______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒是人体必需的微量元素,右图是硒在周期表中的信息,关于硒元素的说法错误的是

A. 位于第四周期
B. 质量数为34
C. 原子最外层有6个电子
D. 相对原子质量为78.96
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理。下列说法正确的是

A. 制取氨气时烧瓶中的固体常用CaO或CaCl2
B. 将湿润的蓝色石蕊试纸置于三颈瓶口,试纸变红,说明NH3已经集满
C. 关闭a,将单孔塞(插有吸入水的胶头滴管)塞紧颈口c,打开b,完成喷泉实验,电脑绘制三颈瓶内压强变化曲线如图2,则E点时喷泉最剧烈
D. 工业上,若出现液氨泄漏,喷稀盐酸比喷洒NaHCO3溶液处理效果好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种电解法制备高纯铬和硫酸的简单装置如图所示。下列说法正确的是![]()
![]()

A. a为直流电源的正极
B. 若有1mol离子通过A膜,理论上阳极生成![]() mol气体
mol气体
C. 工作时,乙池中溶液的pH不变
D. 阴极反应式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)298K时,0.5 mol C2H4 (g)完全燃烧生成二氧化碳和液态水,放出705.5kJ的热量。请写出该反应的热化学方程式______________________。
(2)Na2SO3具有还原性,其水溶液可以吸收Cl2(g),减少环境污染。
已知反应: Na2SO3(aq)+Cl2(g)+H2O(l)=Na2SO4(aq)+2HCl(aq) ΔH1=a kJ·mol1
Cl2(g)+H2O(l)=HCl(aq)+HClO(aq) ΔH2=b kJ·mol1
试写出Na2SO3(aq)与HClO(aq)反应的热化学方程式:________________________。
Ⅱ.红矾钠(Na2Cr2O7·2H2O)是重要的化工原料,工业上用铬铁矿(主要成分是FeO·Cr2O3)制备红矾钠的过程中会发生如下反应:4FeO(s)+4Cr2O3(s)+8Na2CO3(s)+7O2(g) ![]() 8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) ΔH<0
8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) ΔH<0

(1)请写出上述反应的化学平衡常数表达式:K=_____________________。
(2)如图1所示,在0~2min内CO2的平均反应速率为____________________。
(3)图1、图2表示上述反应在2min时达到平衡、在4min时因改变某个条件而发生变化的曲线。由图1判断,反应进行至4min时,曲线发生变化的原因是______________(用文字表达);由图2判断,4min到6min的曲线变化的原因可能是________(填写序号)。
a.升高温度 b.加催化剂 c.通入O2 d.缩小容器体积
(4)工业上可用上述反应中的副产物CO2来生产甲醇:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
已知该反应能自发进行,则下列图像正确的是____________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com