
| A.3︰1 | B.4︰1 | C.2︰1 | D.任意比 |
科目:高中化学 来源:不详 题型:单选题
| A.电解水制氢气时,用铜作阳极 | B.电解法精炼粗铜,用纯铜作阴极 |
| C.电解饱和食盐水制烧碱,阴极上产生氢气 | D.在镀件上电镀锌,用锌作阳极 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电解熔融的氧化铝制取金属铝,用铁作阳极 | B.电解法精炼粗铜,用纯铜作阳极 |
| C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极 | D.在镀件上电镀锌,用锌作阴极 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
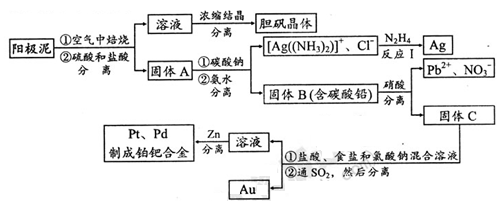
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.阴极只析出H2 | B.阳极先析出Cl2,后析出O2 |
| C.电解最后阶段为电解水 | D.溶液pH不断增大,最后为7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

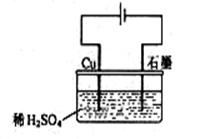
| A.电解过程中,铜电极上有H2产生 |
B.电解初期,主反应方程式为:Cu+H2SO4 CuSO4+H2↑ CuSO4+H2↑ |
| C.电解开始时,石墨电极上有铜析出 |
| D.整个电解过程中,H+的浓度不断增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com