
 CH2、②HC≡CH、③
CH2、②HC≡CH、③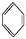 、④HCHO,其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形。
、④HCHO,其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形。 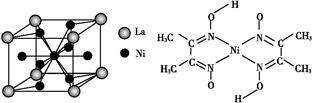
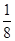 =1,Ni有4个位于面心,另4个在上下两个面上,1个位于体心,所以镍原子个数是4×
=1,Ni有4个位于面心,另4个在上下两个面上,1个位于体心,所以镍原子个数是4×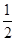 +4×
+4×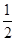 +1=5,所以化学式是LaNi5或Ni5La。
+1=5,所以化学式是LaNi5或Ni5La。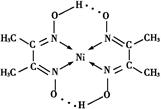


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
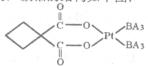
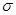 键
键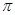 键
键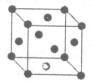
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
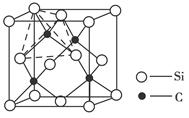
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 、④HCHO,其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形;
、④HCHO,其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形;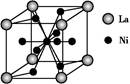
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
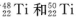 两种原子,它们互称为____。元素在元素周期表中的位置是第_____周期,第____族;基态原子的电子排布式为_____;按电子排布Ti元素在元素周期表分区中属于_____区元素。
两种原子,它们互称为____。元素在元素周期表中的位置是第_____周期,第____族;基态原子的电子排布式为_____;按电子排布Ti元素在元素周期表分区中属于_____区元素。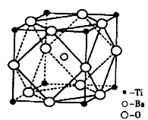
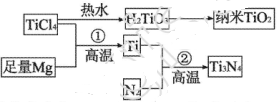 。
。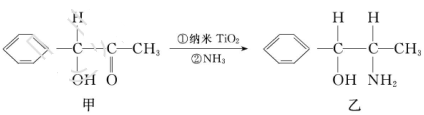
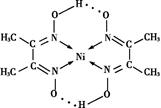
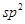 杂化的碳原子个数为_____,化合物乙中采取
杂化的碳原子个数为_____,化合物乙中采取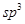 杂化的原子的第一电离能由大到小的顺序为_____。
杂化的原子的第一电离能由大到小的顺序为_____。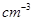 (NA为阿伏加德罗常数的数值,只列算式)。
(NA为阿伏加德罗常数的数值,只列算式)。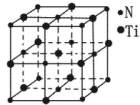
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
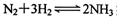 实现储氢和输氢。下列说法正确的是 ;
实现储氢和输氢。下列说法正确的是 ;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com