

分析 (1)2NH3(g)+CO2(g)?NH2COONH4(s),该反应为熵减的过程,若能自发进行,说明该反应为放热反应,据此解答即可;
(2)水会和氨气、二氧化碳反应生成碳酸氢钠;
(3)①反应物氨气必须是干燥的,需要用碱性干燥剂干燥,如碱石灰、固体氢氧化钠或氧化钙等;
②干冰制取的二氧化碳中不含杂质,不需要干燥;该反应为放热反应,干冰变为二氧化碳吸收热量,有利于增大反应物转化率;
③恒压滴液漏斗代替分液漏斗可以平衡内外压强,使氨水顺利滴下;
④反应后期二氧化碳的量减少,可以采取措施让通入的氨气也减少;
(4)依据装置图中流程分析,安全问题主要是堵塞导气管,液体发生倒吸;依据反应过程中的产物分析,不能把污染性的气体排放到空气中,吸收易溶于水的气体需要放倒吸.
解答 解:(1)2NH3(g)+CO2(g)?NH2COONH4(s),该反应为熵减的过程,若能自发进行,说明该反应为放热反应,即△H<0,故答案为:小于;
(2)水会和氨气、二氧化碳反应生成碳酸氢钠,反应的化学方程式为:NH3+CO2+H2O=NH4HCO3;故答案为:NH3+CO2+H2O=NH4HCO3;
(3)①由于制备氨基甲酸铵的原料氨气必须是干燥的,以防止副反应的发生,因此生成的氨气必须进行干燥,因为氨气是碱性气体,所以干燥氨气应该用氧化钙或固体氢氧化钠或碱石灰,故答案为:固体氢氧化钠或碱石灰;
②碳酸盐和酸反应制CO2,则生成的CO2必须进行净化和干燥处理,而直接利用干冰制备CO2,不需要干燥;又因为该反应是放热反应,提供低温环境,可以提高转化率,故答案为:不需要干燥;提供低温环境,提高转化率;
③和普通分液漏斗相比,恒压滴液漏斗上部和三颈烧瓶气压相通,可以保证恒压滴液漏斗中的液体顺利滴下,故答案为:使氨水顺利滴下;
④反应后期,由于二氧化碳的气流下降,导致通入的二氧化碳气体减少,此时可以通过调节恒压滴液漏斗旋塞,减慢氨水的滴加速度,故答案为:调节恒压滴液漏斗旋塞,减慢氨水的滴加速度;
(4)依据装置图中流程分析,安全问题主要是堵塞导气管,液体发生倒吸;依据反应过程中的产物分析,不能把污染性的气体排放到空气中,吸收易溶于水的气体需要放倒吸,实验装置存在安全问题产品易堵塞导管,稀硫酸会倒吸,故答案为:产品易堵塞导管,稀硫酸会倒吸.
点评 本题考查了物质制备实验的设计应用,主要是氨气的制备方法,氨基甲酸的制备实验装置分析判断,实验基本操作,混合物分离的实验设计,题目难度中等.


 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:选择题
 如图所示,两圆圈相交阴影部分表示圆圈内物质相互发生的反应.钠及其氧化物的物质的量均为0.1mol溶于水,形成1L溶液.下列说法正确的是( )
如图所示,两圆圈相交阴影部分表示圆圈内物质相互发生的反应.钠及其氧化物的物质的量均为0.1mol溶于水,形成1L溶液.下列说法正确的是( )| A. | 甲、乙、丙都属于氧化还原反应 | |
| B. | 甲反应的离子方程式为Na+2H2O═Na++2OH-+H2↑ | |
| C. | 丙充分反应,能产生0.05 mol O2,转移电子0.1 mol | |
| D. | 甲、乙、丙充分反应后所得溶液的物质的量浓度为C1、C2、C3,则C1=C2=C3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑥⑦⑧ | B. | ②④⑤⑥⑧ | C. | ②④⑤⑥⑦ | D. | ③④⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3个 | B. | 4个 | C. | 5个 | D. | 6个 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 已知 | 类推 | |
| A | 将Fe加入CuSO4溶液中 Fe+Cu2+=Cu+Fe2+ | 将Na加入到CuSO4溶液中 2Na+Cu2+=Cu+2Na+ |
| B | 向次氯酸钙溶液中通入二氧化碳气体 Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO | 向次氯酸钙溶液中通入二氧化硫气体 Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
| C | 用惰性电极电解CuSO4溶液 2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H- | 用惰性电极电解CuCl2溶液 2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H- |
| D | 将少量CaCO3粉末投入足量盐酸中 CaCO3+2H+═Ca2++CO2↑+H2O | 将少量CaCO3粉末投入足量硝酸溶液中 CaCO3+2H+═Ca2++CO2↑+H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
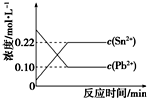 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )| A. | 25℃时,该反应的平衡常数K=2.2 | |
| B. | 往平衡体系中加入金属铅后,c(Pb2+)增大 | |
| C. | 往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 | |
| D. | 升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com