
����Ŀ����.��1���о������ķ���ʴ��ʩ�����ش�������ͼ��ʾװ�ÿ���ģ�����ĵ绯ѧ����������YΪNaCl��
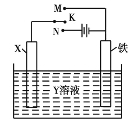
Ϊ�������ĸ�ʴ��
����XΪ̼��������KӦ���� (����ĸ)������ʱX�������ĵ缫��ӦʽΪ ��
����XΪп������K����M�������ʱ���������ĵ缫��ӦʽΪ ��
��2���ڳ����е��³������ݺύ���Ĺܵ��������·�����ϻ��������죬���е���й©�볱ʪ�������У���������ܵ��γɻ�·ʱ���ͻ�������ߵĸ�ʴ��Ϊ��ʾ��ԭ����ij�༶��ѧ������������װ��ͼ(����缫���Ͼ�Ϊ�����������Һ��ΪNaCl��Һ)��
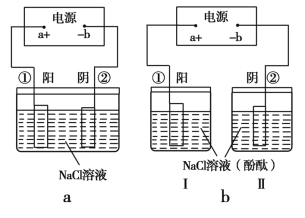
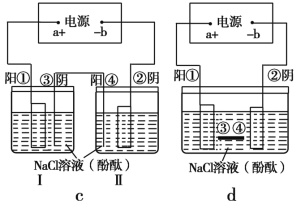
����Ϊ�����ܺ���ģ������ܵ��ĸ�ʴԭ������ ��c(��)���ܷ�Ӧ����ʽ�� ����ͼd �н�ͨ��Դ����ƽ�ŵ���˿���������������� ������Ϊ��ֹ���½����ܵ���ʴ�ṩһ�ֲ��� ��
��.1 Lij��Һ�к��е��������±���
���� | Cu2+ | Al3+ |
| Cl |
���ʵ���Ũ��/(mol/L) | 2 | 1 | 4 | x |
�ö��Ե缫������Һ������·����5 mol ����ͨ��ʱ����Һ��pH= (���Ե��ʱ��Һ����ı仯���缫������ܴ��ڵ��ܽ�����)��
���𰸡���.��1����N 2Cl2e![]() Cl2�� ��O2+2H2O+4e
Cl2�� ��O2+2H2O+4e![]() 4OH
4OH
��2��acd Fe+2H2O![]() Fe(OH)2��+H2�� ��˿�������ɫ�������������������������ɫ����������ɫ������ɻ���ɫ������Ϊ���ɫ �����ڵ��µĽ����ܵ�����Ϳ��ԵĤ(���ϻ������)
Fe(OH)2��+H2�� ��˿�������ɫ�������������������������ɫ����������ɫ������ɻ���ɫ������Ϊ���ɫ �����ڵ��µĽ����ܵ�����Ϳ��ԵĤ(���ϻ������)
��.0
����������.��1������XΪ̼������KӦ����N������������������������ʱX��Ϊ������������Ӧ2Cl2e![]() Cl2��������XΪZn������K����M���������������������������������γ�һ��ԭ���װ�ã�����������Ӧ��O2+2H2O+4e
Cl2��������XΪZn������K����M���������������������������������γ�һ��ԭ���װ�ã�����������Ӧ��O2+2H2O+4e![]() 4OH��
4OH��
��2���۲��ĸ�װ�ã�ֻ��bװ�ò�����Ҫ�����γɱպϻ�·��c(��)������������ʧ���ӣ���������ˮ������������ӵõ��������������ܷ�Ӧ����ʽΪFe+2H2O![]() Fe(OH)2��+H2����װ��c��װ��d��Ч����˿���Ϊ���ص��������������ų�������������ʧ�������ɵ�Fe2+�����Һ�е�OH����˿��������������ɫ����������ɫ������ɻ���ɫ������Ϊ���ɫ��
Fe(OH)2��+H2����װ��c��װ��d��Ч����˿���Ϊ���ص��������������ų�������������ʧ�������ɵ�Fe2+�����Һ�е�OH����˿��������������ɫ����������ɫ������ɻ���ɫ������Ϊ���ɫ��
��.������Һ�ʵ����Ե�c(Cl)=3 mol/L�����ʱ����Һ�����ӷŵ�˳������ΪCu2+>H+������ΪCl>OH������·����5 mol ����ͨ��ʱ��3 mol Cl������������Ӧ2Cl2e![]() Cl2����Ȼ��1 mol H2O������������Ӧ2H2O4e
Cl2����Ȼ��1 mol H2O������������Ӧ2H2O4e![]() O2��+4H+��2 mol Cu2+������������ӦCu2++2e
O2��+4H+��2 mol Cu2+������������ӦCu2++2e![]() Cu��Ȼ��1 mol H+������������Ӧ2H++2e
Cu��Ȼ��1 mol H+������������Ӧ2H++2e![]() H2������ʱ��Һ��c(H+)=1 mol/L������Һ��pH=0��
H2������ʱ��Һ��c(H+)=1 mol/L������Һ��pH=0��


 ��������ܸ�ϰϵ�д�
��������ܸ�ϰϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijУ��ѧʵ����ȤС��Ϊ��Ҫ̽��ʵ�����Ʊ� Cl2 �Ĺ����л���ˮ������ HCl �ӷ�������ͬʱҪ ֤��������ijЩ���ʣ���ͬѧ�������ͼ��ʾ��ʵ��װ�ã�֧���õ�����̨ʡ�ԣ�����Ҫ��ش����⣮
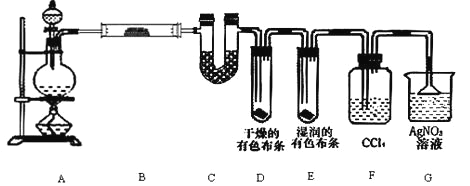
��1�����ú��� 0.2mol HCl ��Ũ������������ MnO2 ��Ӧ�� Cl2���Ƶõ� Cl2 �ڱ�״��������� ��________________1.12L��������������������������С��������ԭ����________________��
��2����װ�� B ��ʢ�ŵ��Լ�����Ϊ__________��������________________
��װ�� D �� E �г��ֵIJ�ͬ����˵����________________
��װ�� F ��������________________
��д��װ�� G �з�����Ҫ��Ӧ�����ӷ���ʽΪ________________��
��3����ͬѧ��Ϊ��ͬѧ��ʵ����ȱ�ݣ�����ȷ������ͨ�� AgNO3 ��Һ�е�����ֻ��һ�֣�Ϊ�� ȷ��ʵ����۵Ŀɿ��ԣ�֤������ͨ�� AgNO3 ��Һ������ֻ��һ�֣���ͬѧ�����ij����װ��֮�� �ټ�һ��װ�ã�����Ϊ��װ��Ӧ����________________��________________֮�䣨��װ����ĸ��ţ���װ����Ӧ����________________����д�Լ�����Ʒ���ƣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(SO2Cl2)��һ����Ҫ�Ļ����Լ����Ȼ����Ǻϳ�������(SO2Cl2)�ij��÷�����
ʵ���Һϳ������ȵ�ʵ��װ������ͼ��ʾ(���ּг�װ��δ����)��

��֪���� SO2(g) + Cl2(g)��SO2Cl2(l) ��H����97.3 kJ/mol��
�������ȳ�����Ϊ��ɫҺ�壬�۵�Ϊ��54.1�棬�е�Ϊ69.1�棬�ڳ�ʪ�����С����̡���
�� 100�����ϻ�ʱ���������ȶ��ֽ⣬���ɶ��������������
�ش��������⣺
(1) װ��A�з�����Ӧ�����ӷ���ʽΪ_________________________________��
(2) װ��B������Ϊ__________________________________________����ȱ��װ��C��װ��D��SO2��Cl2�����ܷ�����Ӧ�Ļ�ѧ����ʽΪ_____________________________��
(3) ����D������Ϊ__________________��E������ˮ�ĵ������____________(�a����b��)��F������Ϊ_____________________��
(4) ��װ��A���ų�����1.12 L(������ɱ�״��)ʱ�����յõ�5.4 g�����������ȣ��������ȵIJ���Ϊ___________��Ϊ��߱�ʵ���������ȵIJ��ʣ���ʵ���������Ҫע���������________(�����)��
�� ��ͨ����ˮ����ͨ�� �� �����������ʣ��������˿�
�� ��������ƿ���̣����ʵ����� �� ����������ƿ
(5) �Ȼ���(ClSO3H)���ȷֽ⣬Ҳ���Ƶ�������2ClSO3H��SO2Cl2 + H2SO4���������ķ�����________
A���ؽᾧ B������ C������ D����ȡ
(6) ���ڴ�ŵ������Ȼᷢ�ƣ���ԭ�����Ϊ____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���l0mL0.1mol/L��HR��Һ������0.lmol/L��NH3��H2O ��Һ��������ҺpH�������Ա仯��ͼ�����з�������ȷ����

A. ab�㵼��������ǿ��˵��HRΪ����
B. b����Һ��c(NH3H2O)=c(R-)+c(H+)-c(OH-)
C. c����Һ������c(NH4+)>c(R-)>c(OH-)>c(H+)
D. �����£�HR��NH3H2O�ĵ���ƽ�ⳣ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���㶹��-4��һ�ּ���Ⱦ�ϣ�Ӧ���ڿɵ�гȾ�ϼ��������㶹��-4��C��H��O����Ԫ����ɣ��������ģ����ͼ��ʾ�������й�������ȷ����

�ٷ���ʽΪ![]()
�����뱥����ˮ����ȡ����Ӧ
�����뱥����ˮ�����ӳɷ�Ӧ
����ʹ����![]() ��Һ��ɫ
��Һ��ɫ
��1mol�㶹��-4������뺬1molNaOH����Һ��Ӧ
A. �٢ڢ� B. �ۢܢ� C. �ڢۢ� D. �ڢۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�У���Ԫ�ر��ֳ������Ե���
A. H2SO4+Zn=ZnSO4��H2�� B. 2SO2+O2![]() 2SO3
2SO3
C. 2H2SO4(Ũ)+Cu![]() CuSO4(Ũ)+SO2��+2H2O D. SO3+H2O=H2SO4
CuSO4(Ũ)+SO2��+2H2O D. SO3+H2O=H2SO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͭ���仯�������ճ����������������Ź㷺��Ӧ�á��ش��������⣺
��1����Ԫ�������ڱ��е�λ����_______����̬Cu2+�ĺ�������Ų�ʽ��__________��Ԫ������ͭ�ĵڶ������ֱܷ�Ϊ��ICu=1958 kJ��mol-1��IFe=1561 kJ��mol-1��ICu��IFe��ԭ����_________________��
��2���л����������������غ���(��)����ѧʽΪ��[Fe(H2NCONH2)6](NO3)3��
�����ط�����Cԭ�ӵ��ӻ���ʽ��__________��
��[Fe(H2NCONH2)6](NO3)3 ����H2NCONH2���� Fe(��)֮�����������_______�����ݼ۲���ӶԻ��������Ʋ� NO3���Ŀռ乹��Ϊ____________��
��3��Fe3+����SCN�����飬���Ӧ���������֣��ֱ�Ϊ�����ᣨH-S-C��N�����������ᣨH-N=C=S�������������зе�ϸߵ���_______�� ԭ����______________��
��4��FeCl3����������ˮ���Ҵ����þƾ��Ƽ��ȼ����������ɴ˿�֪ FeCl3�ľ�������Ϊ______��S��Fe�γɵ�ij������侧����ͼһ��ʾ�� ������ʵĻ�ѧʽΪ__________��

��5��Cu����Ķѻ���ʽ��ͼ����ʾ��������Cuԭ�ӵ���λ��Ϊ_______����Cuԭ�Ӱ뾶Ϊa������ռ�������Ϊ _________���ú�a ��ʽ�ӱ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A. 1mol N2 ��������14g B. H2SO4��Ħ��������98 g/mol
C. H2O��Ħ��������18 D. 1mol HCl��������36.5 g /mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��2008�걱�����˻��������������κ���������(The Bird Nest),��һ�ѧ����Ҳ�������绯ѧʽ��B5H9�������飨��ͼ���� �����������Ħ��������____g/mol��

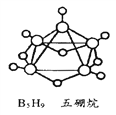
��2����ͬ��ͬѹ�£�ͬ����ļ��飨CH4���Ͷ�����̼������֮��Ϊ______������֮��Ϊ______���ܶ�֮��Ϊ________��
���������������ˮ ��39�����Ҵ���Һ���Ҵ��ķе�Ϊ78.4���������ͺ��Ȼ�����Һ���������ϸ���������ȷʵ�鷽��������_______ ��________��_________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com