
【题目】下列能层中,有f能级的是( )
A.K
B.L
C.M
D.N
科目:高中化学 来源: 题型:
【题目】某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示. 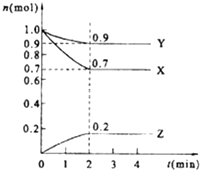
(1)由图中所给数据进行分析,该反应的化学方程式为;
(2)反应从开始至2分钟,用Z的浓度变化表示的平均反应速率为v(Z)=;
(3)将a mol X与b mol Y的混合气体发生上述反应,反应到某时刻各物质的量恰好满足: n (X)=n (Y)=n (Z),则原混合气体中a:b= .
(4)下列措施能加快反应速率的是(多选).
A.恒压时充入He
B.恒容时充入He
C.恒容时充入X
D.及时分离出Z
E.升高温度
F.选择高效的催化剂
(5)下列说法正确的是(单选).
A.升高温度改变化学反应的限度
B.已知正反应是吸热反应,升高温度平衡向右移动,正反应速率加快,逆反应速率减慢
C.化学反应的限度是不可能改变的
D.增大Y的浓度,正反应速率加快,逆反应速率减慢.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铅蓄电池电解甲、乙电解池中的溶液。己知铅蓄电池的总反应为:Pb(s)+PbO2(s)+2H2SO4(aq)![]() 2PbSO4(s)+2H2O(l)电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )
2PbSO4(s)+2H2O(l)电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )

A. d极为阴极
B. 放电时铅蓄电池负极的电极反应式为:PbO2(s)+4H+(aq)+SO42-(aq)+4e-=PbSO4(s)+2H2O(l)
C. 若利用甲池精炼铜,b极应为粗铜
D. 若四个电极材料均为石墨,当析出6.4gCu时,两池中共产生气体3.36L(标准状况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)是第四周期ⅤA族元素,可以形成As2O3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图____________。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式________。该反应需要在加压下进行,原因是________。
(3)已知:As(s)+![]() H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+![]() O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
2As(s)+![]() O2(g) =As2O5(s) ΔH3
O2(g) =As2O5(s) ΔH3
则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =_________。
(4)298 K时,将20 mL 3x mol·L1 Na3AsO3、20 mL 3x mol·L1 I2和20 mL NaOH溶液混合,发生反应:AsO33(aq)+I2(aq)+2OH![]() AsO43(aq)+2I(aq)+ H2O(l)。溶液中c(AsO43)与反应时间(t)的关系如图所示。
AsO43(aq)+2I(aq)+ H2O(l)。溶液中c(AsO43)与反应时间(t)的关系如图所示。

①下列可判断反应达到平衡的是__________(填标号)。
a.溶液的pH不再变化
b.v(I)=2v(AsO33)
c. c (AsO43)/c (AsO33)不再变化
d. c(I)=y mol·L1
②tm时,v正_____ v逆(填“大于”“小于”或“等于”)。
③tm时v逆_____ tn时v逆(填“大于”“小于”或“等于”),理由是_____________。
④若平衡时溶液的pH=14,则该反应的平衡常数K为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“爆竹声中一岁除,春风送暖入屠苏。千门万户瞳瞳日,总把新桃换旧符。”是王安石的作品《元日》,其中的“屠苏”是一种酒。下列说法错误的是( )
A.黑火药是由硫黄、硝石和木炭按照一定比例混合而成
B.“屠苏”中不含非电解质
C.爆竹爆炸发生了化学变化
D.早期的桃符大都是木质的,其主要成分纤维素可以发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在密闭容器中SO2、O2、SO3三种气态物质建立化学平衡后,改变条件对反应2SO2(g)+O2(g)2SO3(g),△H<0的正、逆反应速率的影响如图所示: 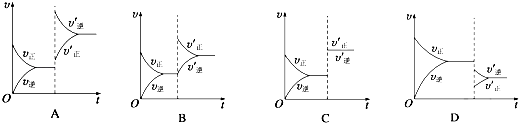
(1)加催化剂对反应速率影响的图像是(填序号,下同),平衡移动.
(2)升高温度对反应速率影响的图像是 , 平衡向方向移动.
(3)增大反应容器体积对反应速率影响的图像是 , 平衡向方向移动.
(4)增大O2的浓度对反应速率影响的图像是 , 平衡向方向移动.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.硫在地壳中主要以硫化物、硫酸盐等形式存在,其单质和化合物在工农业生产中有着重要的应用。
(1)利用下图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。
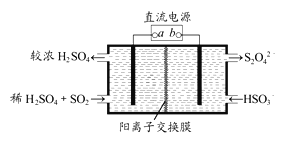
①阳极的电极反应式为__________________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应中氧化剂与还原剂的物质的量之比为_________。
Ⅱ.乙炔(C2H2)在气焊、气割及有机合成中用途非常广泛,可由电石(CaC2)直接水化法或甲烷在1500℃左右气相裂解法生产。哈斯特研究得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图所示。
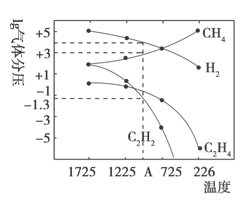
(2)T2℃时,向1L恒容密闭容器中充入0.3molCH4只发生反应2CH4(g)![]() C2H4(g)+2H2(g) ΔH,达到平衡时,测得c(C2H4)= c(CH4)。该反应的ΔH____0(填“>”或“<”),CH4的平衡转化率为_________。上述平衡状态某一时刻,若改变温度至T℃,CH4以0.01mol/(L·s)的平均速率增多,经ts后再次达到平衡,平衡时2c(C2H4) = c(CH4),则t=________s。
C2H4(g)+2H2(g) ΔH,达到平衡时,测得c(C2H4)= c(CH4)。该反应的ΔH____0(填“>”或“<”),CH4的平衡转化率为_________。上述平衡状态某一时刻,若改变温度至T℃,CH4以0.01mol/(L·s)的平均速率增多,经ts后再次达到平衡,平衡时2c(C2H4) = c(CH4),则t=________s。
(3)列式计算反应2CH4(g) =C2H2(g)+3H2(g)在图中A点温度时的平衡常数K=_________(用平衡分压代替平衡浓度计算:lg![]() ≈ -1.3)。
≈ -1.3)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com