
分析 (1)先根据W的物质的量求出X的物质的量的变化量,根据v=$\frac{△n}{△t}$计算v(X);
(2)利用速率之比等于化学计量数之比计算n的值;计算出2min内Y的浓度变化量,2min末时Y的浓度为Y的起始浓度减去2min内Y的浓度变化量;
解答 解:(1)物质的量之比等于化学计量数之比,所以△n(X)=$\frac{2}{3}$△n(W)=$\frac{2}{3}$×0.6mol=0.4mol,
2min内用X的浓度变化表示的平均反应速率v(X)=$\frac{△c(X)}{△t}$=$\frac{\frac{0.4mol}{2L}}{2min}$=0.1 mol•(L•min)-1,
答:前2min内用X的浓度变化表示的平均反应速率为0.1 mol•(L•min)-1;
(2)速率之比等于化学计量数之比,所以0.1 mol•(L•min)-1:0.1 mol•(L•min)-1=4:n,解得,n=4;物质的量之比等于化学计量数之比,所以△n(Y)=$\frac{5}{6}$△n(W)=$\frac{5}{6}$×0.6mol=0.5mol,
所以2min内Y的浓度变化量△c(Y)=$\frac{△n(Y)}{V}$=$\frac{0.5mol}{2L}$=0.25mol/L,
Y的起始浓度为$\frac{1.2mol}{2L}$=0.6mol/L,
所以2min末时Y的浓度为0.6mol/L-0.25mol/L=0.35mol/L,
答:n的值是4;2min末时Y的浓度为0.35mol/L.
点评 本题考查化学反应速率的计算,难度不大,注意基础知识的掌握.


科目:高中化学 来源: 题型:解答题
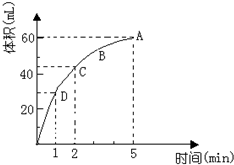 加入0.1mol的MnO2粉末于50mL过氧化氢的溶液中(密度为 1.1g/mL),在标准状况下放出气体的体积和时间的关系如图所示,回答下列问题:
加入0.1mol的MnO2粉末于50mL过氧化氢的溶液中(密度为 1.1g/mL),在标准状况下放出气体的体积和时间的关系如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验 序号 | t/min c/(mol•L-1) 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800 | 1.0 | 0.80 | 0.67 | 0.50 | 0.50 | 0.50 | 0.50 |
| 2 | 800 | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800 | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com