
| A. | 三者的单质直接与O2反应都能生成两种以上的氧化物 | |
| B. | CO2、NO2、SO2都能与H2O发生化合反应 | |
| C. | CO2、NO2、SO2都是大气污染气体,在空气中都能稳定存在 | |
| D. | 三种元素在自然界中既有游离态又有化合态 |
分析 A、硫和氧气反应只生成二氧化硫,氮气和氧气放电反应生成一氧化氮;
B、二氧化氮和水发生氧化还原反应;
C、CO2不是大气污染物;
D、氮元素在自然界中主要以氮气的形式存在,C元素、S元素在自然界中也有单质形式存在.
解答 解:A、碳和氧气反应可以生成一氧化碳、二氧化碳,硫和氧气反应只生成二氧化硫,二氧化硫被氧化生成三氧化硫时必须有催化剂和加热条件,氮气和氧气放电反应生成一氧化氮,一氧化氮和氧气反应生成二氧化氮,故A错误;
B、二氧化氮和水发生氧化还原反应,生成硝酸和一氧化氮,非化合反应,故B错误;
C、CO2不是大气污染物,故C错误;
D、氮元素在自然界中主要以氮气的形式存在,C元素、S元素在自然界中也有单质形式存在,这些元素都有游离态,故D正确;
故选D.
点评 本题涉及含有C、N、S三种元素的物质的性质知识,属于综合知识的考查,难度中等.


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:实验题
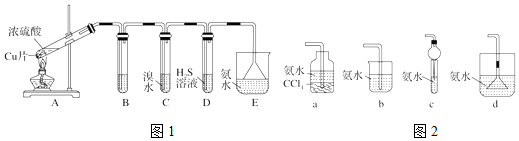
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在铁门上焊接铜块既美观,又能防腐蚀 | |
| B. | 古代青铜文物在干燥环境中的腐蚀比潮湿环境中快 | |
| C. | 纯银器表面在空气中因化学腐蚀渐渐变暗 | |
| D. | 可将地下输油管与外加直流电源的正极相连以保护它不受腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +6 | B. | +4 | C. | +3 | D. | +2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
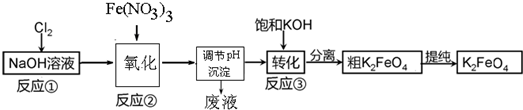

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 伴随着能量变化的物质变化都是化学变化 | |
| C. | 如图可表示Ba(OH)2•8H2O与NH4Cl晶体反应的能量变化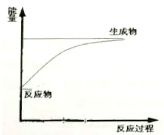 | |
| D. | 1L1mol/L的硫酸与足量的NaOH溶液所放出的热为中和热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ①②⑤ | C. | ②③④⑤ | D. | ①⑥⑦⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com